
分析 (1)①根据原子守恒判断X物质,根据X的构成微粒确定其晶体类型;
②相同类型的离子晶体中,晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
(2)①根据价层电子对互斥理论确定其杂化类型;
②利用均摊法计算.
解答 解:(1)①根据元素守恒及原子守恒知,X是碳酸钠,碳酸钠是由阴阳离子构成的离子晶体;
故答案为:离子;
②MgO晶体的熔点比CaO高都属于离子晶体,Mg2+半径比Ca2+小,键能较大,所以氧化镁晶体的晶格能大于氧化钙,导致氧化镁晶体的熔点大于氧化钙,故答案为:Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高;
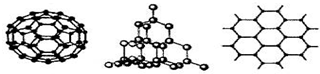
(2)①金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,所以每个碳原子的价层电子对是4,则碳原子采取sp3杂化,
故答案为:sp3;
②石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6×$\frac{1}{2}$3;
故答案为:3.
点评 本题考查离子晶体的性质,原子的杂化方式和均摊法,注意晶格能的大小比较以及利用均摊法计算晶胞中各种原子个数是难点,题目难度大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃、101kPa下,64g SO2中含有的原子数为3NA | |
| C. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔点:钾<铷<铯 | B. | 离子半径:S2->Na+>Mg2+ | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:H2SiO3<H3PO4<H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高吸水性树脂属于功能高分子材料 | |
| B. | 食品包装袋、食物保鲜膜等材料的主要成份是聚乙烯 | |
| C. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 高分子化合物的结构大致可以分为线型结构、支链型结构和网状结构三类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 利用腐蚀法制作印刷线路板:2Fe3++Cu═2Fe+Cu2+ | |
| C. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称量前先调节托盘天平的零点 | |
| B. | 称量时左盘放被称量物,右盘放砝码 | |
| C. | 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量.其他固体药品可直接放在天平托盘上称量 | |
| D. | 用托盘天平可以准确称量药品0.01g | |
| E. | 称量完毕应把砝码放回砝码盒中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色的氧化铜 | B. | 红色的氧化亚铜 | ||
| C. | 蓝色的氢氧化铜和碳酸铜 | D. | 黑色的氧化亚铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com