
| A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y) |
| B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-) |
| C.若溶液中粒子浓度关系为c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性 |
| D.将NaHY晶体加入水中一定能促进水的电离 |
科目:高中化学 来源:不详 题型:单选题

| A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>c(A2-)>c(OHˉ) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D.向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两溶液中均存在电离平衡和水解平衡 |
| B.两溶液分别加水稀释后,pH和KW均减小 |
| C.两溶液中均存在c(OH-)+2c(CO32—)+c(HCO3—)=c(Na+)+c(H+) |
| D.c(OH-)前者大于后者 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
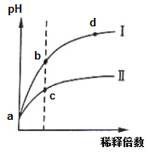
| A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线 |
| B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同 |
| C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同 |
| D.c点溶液的导电能力一定比b点溶液导电能力强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
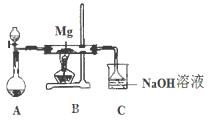
| A.(Na+)= 2c(SO32-)+ c(HSO3-), |
| B.(Na+)> c(HSO3-)> c(SO32-)> c(H+)> c(OH-), |
| C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-), |
| D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-) |
 2MgSO3+S;
2MgSO3+S; 2MgO+MgS,
2MgO+MgS,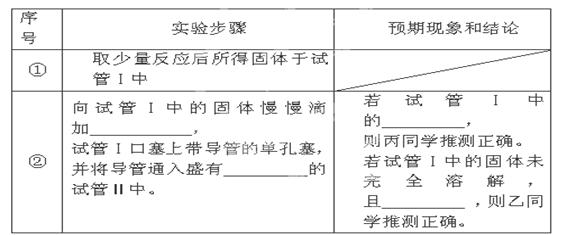
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com