
| A.草木灰不能与铵混合使用态氮肥 |
| B.铁在潮湿的环境下生锈 |
| C.加热氯化铁溶液颜色变深 |
| D.浓硫化钠溶液有臭味 |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y) |
| B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-) |
| C.若溶液中粒子浓度关系为c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性 |
| D.将NaHY晶体加入水中一定能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.溶液中阳离子的物质的量浓度之和: Na2CO3 > NaCN > NaHCO3 |
| B.相同条件下的酸性: H2CO3 < HCN |
| C.三种溶液中均存在电离平衡和水解平衡 |
D.升高 Na2CO3溶液的温度,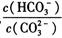 减小 减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.均存在电离平衡和水解平衡 | B.存在的粒子种类相同 |
| C.c(H+)前者小于后者 | D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
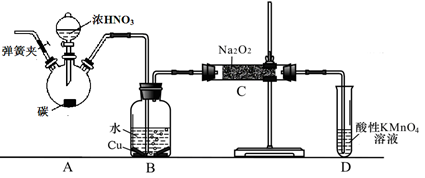
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
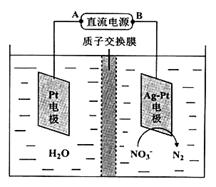
科目:高中化学 来源:不详 题型:单选题
| A.c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| B.c(K+)+ c(S2-) = 0.3mol/L |
| C.c(K+)=c(S2-)+c(HS-)+c(H2S) |
| D.c(OH-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com