
| A. | 常温下,测定0.1mol•L-1CH3COOH的pH值,若pH大于1,即可证明为弱电解质 | |
| B. | 等体积的0.1mol•L-1HCl和0.1mol•L-1醋酸溶液,分别与等量的相同颗粒度的Zn反应,观察产生气泡的速率,即可证明 | |
| C. | 等体积的0.1mol•L-1HCl和 0.1mol•L-1醋酸溶液,比较中和这两种酸所需相同物质的量浓度的NaOH溶液的体积,即可证明 | |
| D. | 常温下,测一定浓度的CH3COONa溶液的pH值,若pH大于7,即可证明 |
分析 要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.常温下,测定0.1mol•L-1CH3COOH的pH值,若pH大于1,说明存在电离平衡,醋酸为弱电解质,故A正确;
B.等体积的0.1mol•L-1HCl和0.1mol•L-1醋酸溶液,分别与等量的相同颗粒度的Zn反应,随反应进行醋酸又电离出氢离子,反应速率大于盐酸溶液,说明存在电离平衡,观察产生气泡的速率可以证明醋酸为弱电解质,故B正确;
C.等体积的0.1mol•L-1HCl和 0.1mol•L-1醋酸溶液,中和氢氧化钠相同,不能说明醋酸为弱电解质,故C错误;
D.常温下,测一定浓度的CH3COONa溶液的pH值,若pH大于7,说明阴离子水解溶液显碱性,说明对应酸为弱酸,证明醋酸为弱电解质,故D正确;
故选C.
点评 本题考查了弱电解质的判断,题目难度不大,电解质强弱是根据其电离程度划分的,不能根据溶液导电性强弱划分,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 二甲醚与乙醇互为同分异构体 | |
| B. | CH3OCH3中只含有极性共价键 | |
| C. | CH3OH和乙醇均可发生消去反应 | |
| D. | 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)═CH3OCH3 (g)+CO2(g)△H=-248.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质在过量的空气中燃烧生成SO3 | |
| B. | 自然界的硫元素主要以硫单质、硫化物和硫酸盐等形式存在 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性与酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
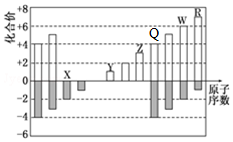 部分短周期元素化合价与原子序数的关系可用图表示.
部分短周期元素化合价与原子序数的关系可用图表示.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S和HCl | B. | Na2CO3和H2SO4 | C. | NaHCO3和HCl | D. | Na2SO3和 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下可用铁制或铝制容器盛装浓硝酸 | |
| B. | 高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 | |
| C. | SO2气体可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性 | |
| D. | 二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ⑤>②>①>③>④ | B. | ③>②>①>⑤>④ | C. | ⑤>②>③>④>① | D. | ③>④>⑤>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com