
| A. | Na2S和HCl | B. | Na2CO3和H2SO4 | C. | NaHCO3和HCl | D. | Na2SO3和 H2SO4 |
分析 C与NaOH溶液反应生成A,可说明A为钠盐,C最终氧化成D,可说明C具有还原性,选项中符合的气体为SO2、H2S,最终被氧化生成SO3,B应为H2SO4.
解答 解:选项中可生成的气体为SO2、H2S,对应的盐可分别为Na2SO3、Na2S,SO2、H2S具有还原性,最终被氧化生成SO3,B应为H2SO4,
A.Na2S和HCl反应生成NaCl和H2S,H2S+2NaOH=Na2S+H2O,H2S最终能被氧化为三氧化硫,溶于水得到硫酸,故A错误;
B.Na2CO3和H2SO4反应生成硫酸钠和二氧化碳,二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,二氧化碳不能被氧化,故B错误;
C.NaHCO3和HCl反应生成硫酸钠和二氧化碳,二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,二氧化碳不能被氧化,故C错误;
D.Na2SO3和 H2SO4 反应生硫酸钠、二氧化硫和水,二氧化硫和氢氧化钠反应生成亚硫酸钠和水,二氧化硫最后也会为三氧化硫,溶于水生成硫酸,故D正确;
故选D.
点评 本题考查物质的检验和推断,为高频考点,侧重学生的分析能力的考查,注意把握二氧化硫和硫化氢的性质,难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
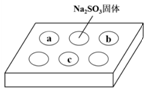 某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S
某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S| 序号 | 试剂 | 实验现象 |
| a | 品红溶液 | 红色褪去 |
| b | 酸性KMnO4溶液 | 紫色褪去 |
| c | NaOH溶液(含2滴酚酞) | 红色褪去 |
| A. | 浓硫酸与Na2SO3固体发生了氧化还原反应 | |
| B. | a、b均表明SO2具有漂白性 | |
| C. | c中只可能发生反应:SO2+2OH-═SO32-+H2O | |
| D. | c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 项目名称 | 数据 | 参考值 |
| 尿素氮 | 3.95 | 2.00-6.10 m mol•L-1 |
| 葡萄糖 | 4.50 | 3.89-6.11 m mol•L-1 |
| 总胆固醇 | 3.80 | <5.20 m mol•L-1 |
| 甘油三酯 | 1.85↑ | <1.70 m mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,测定0.1mol•L-1CH3COOH的pH值,若pH大于1,即可证明为弱电解质 | |
| B. | 等体积的0.1mol•L-1HCl和0.1mol•L-1醋酸溶液,分别与等量的相同颗粒度的Zn反应,观察产生气泡的速率,即可证明 | |
| C. | 等体积的0.1mol•L-1HCl和 0.1mol•L-1醋酸溶液,比较中和这两种酸所需相同物质的量浓度的NaOH溶液的体积,即可证明 | |
| D. | 常温下,测一定浓度的CH3COONa溶液的pH值,若pH大于7,即可证明 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
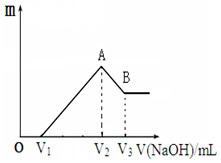 将镁、铝的混合物共0.1mol,溶于200mL 2.5mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:
将镁、铝的混合物共0.1mol,溶于200mL 2.5mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
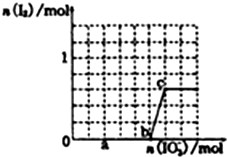 (1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为非金属性Cl强于S,所以向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com