
|
下列海水中的元素中,对其用途的说明中不正确的是 | |
A. |
锂作为热核反应的重要材料 |
B. |
碘用于医药制碘酒 |
C. |
铀用于制氢弹 |
D. |
镁用于制造飞机汽车 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:全优设计必修一化学人教版 人教版 题型:058
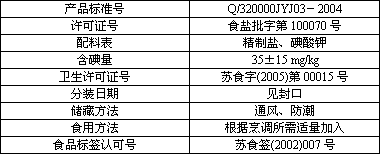
Ⅰ.下表是百姓超市出售的“淮牌”加碘精制盐的有关说明:
Ⅱ.下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在.碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源.目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在.通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等黏膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡.碘遇淀粉(面粉的主要成分)会出现明显的蓝色.碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2![]() 2NaHSO4+MnSO4+2H2O+I2 ①
2NaHSO4+MnSO4+2H2O+I2 ①
2NaIO3+5NaHSO3![]() 2NaSO4+3NaHSO4+H2O+I2 ②
2NaSO4+3NaHSO4+H2O+I2 ②
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应.
根据以上信息,完成下列问题:
(1)反应①反应②的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3![]() H++HSO
H++HSO![]() )
)
反应①:________;
反应②:________;
I2在反应①中是________(填“氧化”或“还原”,下同)产物,在反应②中是________产物.
(2)请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素.
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:
a.认识碘酸钾中的碘元素转变成碘单质的化学反应;
b.________.
实验原理:(提示:结合题中信息和实验目的进行分析)________.
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________.
实验步骤:(用准确、简洁的语言填写下表)

问题讨论:某地有100多千米的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是该地方人的主要副食品,该地方人的食用盐中需要加碘吗?说明你的理由.
查看答案和解析>>
科目:高中化学 来源:志鸿系列全优设计必修一化学人教版 人教版 题型:058
Ⅰ.下表是百姓超市出售的“淮牌”加碘精制盐的有关说明:

Ⅱ.下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在.碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源.目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在.通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等黏膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡.碘遇淀粉(面粉的主要成分)会出现明显的蓝色.碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2![]() 2NaHSO4+MnSO4+2H2O+I2 ①
2NaHSO4+MnSO4+2H2O+I2 ①
2NaIO3+5NaHSO3![]() 2NaSO4+3NaHSO4+H2O+I2 ②
2NaSO4+3NaHSO4+H2O+I2 ②
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应.
根据以上信息,完成下列问题:
(1)反应①反应②的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3![]() H++
H++![]() )
)
反应①:________;
反应②:________;
I2在反应①中是________(填“氧化”或“还原”,下同)产物,在反应②中是________产物.
(2)请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素.
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:
A.认识碘酸钾中的碘元素转变成碘单质的化学反应;
B.________.
实验原理:(提示:结合题中信息和实验目的进行分析)________.
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________.
实验步骤:(用准确、简洁的语言填写下表)

问题讨论:某地有100多千米的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是该地方人的主要副食品,该地方人的食用盐中需要加碘吗?说明你的理由.
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中溶解了大量的气体物质和各种盐类。人类在陆地上发现的100多种元素,在海水中可以找到80多种。海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。
回答下列问题:
⑴ 蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大。为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议 。
⑵ 使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
⑶ 空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
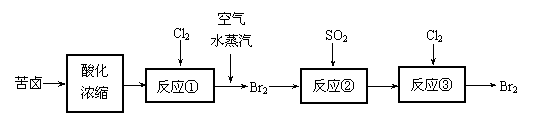
① 反应②的离子方程式为 ;
② 从反应③后的溶液中分离出单质溴的方法是 。
⑷ 苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有 ;
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
产品标准号 | Q/320000JYJ03-2004 |
许可证号 | 食盐批字第100070号 |
配料表 | 精制盐、碘酸钾 |
含碘量 | 35±15 mg/kg |
卫生许可证号 | 苏食字(2005)第00015号 |
分装日期 | 见封口 |
储藏方法 | 通风、防潮 |
食用方法 | 根据烹调所需适量加入 |
食品标签认可号 | 苏食签(2002)007号 |
Ⅱ.下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等黏膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:?
2NaI+3H2SO4+MnO2![]() 2NaHSO4+MnSO4+2H2O+I2 ①
2NaHSO4+MnSO4+2H2O+I2 ①
2NaIO3+5NaHSO3![]() 2NaSO4+3NaHSO4+H2O+I2 ②
2NaSO4+3NaHSO4+H2O+I2 ②
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应。?
根据以上信息,完成下列问题:?
(1)反应①反应②的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3![]() H++HSO
H++HSO![]() )
)
反应①:________________________________ ;?
反应②:________________________________ ;?
I2在反应①中是_______(填“氧化”或“还原”,下同)产物,在反应②中是_______产物。?
(2)请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素。?
实验名称:探究“淮牌”精制盐中是否含有碘元素?
实验目的:?
a.认识碘酸钾中的碘元素转变成碘单质的化学反应;?
b.________________________________ 。?
实验原理:(提示:结合题中信息和实验目的进行分析)________________________。?
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________________。?
实验步骤:(用准确、简洁的语言填写下表)
实验步骤 | 实验现象 | 化学方程式或实验结论 |
| 固体在水中溶解 |
|
| 溶液出现棕黄色 | — |
|
| “淮牌”精制盐中含有碘元素 |
问题讨论:某地有100多千米的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是该地方人的主要副食品,该地方人的食用盐中需要加碘吗?说明你的理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com