
[ ]
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:湖南省长沙市一中2009-2010年高三第二次月考 化学试卷 题型:038
将5.1 g镁铝合金溶于60 mL 5 mol·L-1的H2SO4溶液中,完全溶解后再加入65 mL 10.0 mol·L-1的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少.
(1)当加入________mL NaOH溶液时,可使溶液在硫酸中的Mg和Al恰好完全沉淀.
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省盟校十校联考高三第一次联考理综化学试卷(解析版) 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
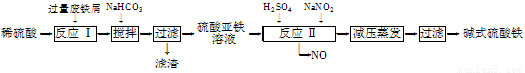
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是????????????????????????? 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是???????????????????????? 。
(3)反应Ⅱ的离子方程式为????????????????????????? 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作????????? 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为??????????????? 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为????????????????????????????????????????????????? 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为??????? 。
A.氯水??? ? B.KSCN溶液??? ? C.NaOH溶液??? ? D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为??????? 。
A.22.1 g?????? B.27.2 g???????? C.30 g?????????? D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
将5.1 g镁铝合金溶于600 mL 0.5 mol·L-1H![]() SO
SO![]() 溶液中,完全溶解后再加入1.0 mol·L-1
溶液中,完全溶解后再加入1.0 mol·L-1
的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入_____mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
(08杭州市质检)将5.1 g镁铝合金溶于600 mL 0.5 mol?L-1H![]() SO
SO![]() 溶液中,完全溶解后再加入1.0 mol?L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
溶液中,完全溶解后再加入1.0 mol?L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入___▲__mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com