
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物、硫酸盐以及高价铁的含氧酸盐均为重要化合物。
(1)在实验室中,FeCl2 可用铁粉和盐酸反应制备,FeCl3可用铁粉和_____反应制备: 现有一含FeCl2和FeCl3的混合物的样品,测得样品中n(Fe):n(Cl) = 1:2.3,则该样品中FeCl3的物质的量分数为____________。
(2)高温下,Fe 与水蒸气反应的化学方程式为____________________。
(3)硫酸亚铁、氯化亚铁溶液存放在实验室均易变质,出现红褐色沉淀,且溶液变棕黄色,则此反应的离子方程式为____________________。
(4)在氯化亚铁溶液中加入等物质的量的过氧化钠,发生反应的总的离子方程式为____________________。
【答案】 Cl2 30% 3Fe+4H2O(g) ![]() Fe3O4+4H2 12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓ 4Fe2++4Na2O2+6H2O=8Na++4Fe(OH)3↓+O2↑
Fe3O4+4H2 12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓ 4Fe2++4Na2O2+6H2O=8Na++4Fe(OH)3↓+O2↑
【解析】试题分析:本题考查铁元素的单质及其化合物的性质,化学方程式和离子方程式的书写,化学计算。
(1)FeCl3中Fe为+3价,FeCl3可用Fe粉和Cl2反应制备,反应的化学方程式为2Fe+3Cl2![]() 2FeCl3。因为n(Fe):n(Cl)=1:2.3,则[n(FeCl3)+n(FeCl2)]:[3n(FeCl3)+2n(FeCl2)]=1:2.3,n(FeCl3):n(FeCl2)=3:7,样品中FeCl3物质的量分数为
2FeCl3。因为n(Fe):n(Cl)=1:2.3,则[n(FeCl3)+n(FeCl2)]:[3n(FeCl3)+2n(FeCl2)]=1:2.3,n(FeCl3):n(FeCl2)=3:7,样品中FeCl3物质的量分数为![]() 100%=30%。
100%=30%。
(2)高温下铁与水蒸气反应生成Fe3O4和H2,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(3)硫酸亚铁、氯化亚铁溶液存放在实验室均易变质,出现红褐色沉淀,溶液变成棕黄色,说明Fe2+被空气中O2氧化成Fe3+和Fe(OH)3,反应可写成Fe2++O2→Fe(OH)3↓+Fe3+,1molFe2+反应失去1mol电子,1molO2反应得到4mol电子,根据得失电子守恒、电荷守恒以及原子守恒,写出离子方程式为12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+。
(4)在氯化亚铁溶液中加入Na2O2,发生的反应有2Na2O2+2H2O=4NaOH+O2↑(①)、FeCl2+2NaOH=Fe(OH)2↓+2NaCl(②)、4Fe(OH)2+O2+2H2O=4Fe(OH)3(③);FeCl2与Na2O2物质的量相等,将①![]() 2+②
2+②![]() 4+③得总反应的化学方程式为4Na2O2+4FeCl2+6H2O=8NaCl+4Fe(OH)3↓+O2↑,总反应的离子方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+O2↑。
4+③得总反应的化学方程式为4Na2O2+4FeCl2+6H2O=8NaCl+4Fe(OH)3↓+O2↑,总反应的离子方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+O2↑。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:![]() 。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
A. ①② B. ③④ C. ②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年10月12日北京时间上午9时,中国酒泉卫星发射中心成功将“神舟6号”飞船送入太空,这一壮举又一次受到世界关注.火箭推进器中有强还原剂液体肼(N2H4)和强氧化剂液态双氧水.当它们混合时,即产生大量氮气和水蒸气并放出大量热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.
(1)反应的热化学方程
(2)又已知H2O(l)=H2O(g)△H=44kJ.mol﹣1 . 则16g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是 .
(4)燃料电池在航天器得到大量应用;科研人员新近开发出一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,充电一次可供手机连续使用一个月,据此请回答以下问题:
①甲醇是极,电极反应
②电池反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,FeS的Ksp=6.25×10﹣18(设饱和溶液的目睹为1g/mL),若已知H2S饱和溶液在常温下,c(H+)与c(S2﹣)之间存在以下关系:c2(H+)c(S2﹣)=1.0×10﹣22 , 该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1mol/L,应调节溶液的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验现象有干扰,过多的NO、NO2又会污染环境。改进实验的设计符合绿色化学的思想。某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化。
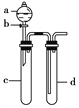
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是____________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜块,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是___________________________________________。
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该兴趣小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为_______________________,实验现象为________________________________;但此实验的不足之处是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)Fe(s)+CO2(g)△H>0
试回答下列问题:
(1)写出该反应的平衡常数表达式 .
(2)升高温度,该反应的平衡常数K值将(填“增大”、“减小”、“不变”),平衡体系中固体的质量将( 填“增大”、“减小”、“不变”).
(3)已知1100℃时该反应的平衡常数K=0.263.在该温度测得高炉中c(CO2)=0.025molL﹣1 , c(CO)=0.1molL﹣1 , 此时该的化学反应速度是v(正)(填“>”、“<”、“=”)v(逆).
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值(填”>”、“<”、“=”)0.263.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.Na2SO4=2Na++SO42-B.FeCl3=Fe2++3C1-
C.Ba(OH)2=Ba2++(OH)22-D.NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁的单质及其化合物在储氢及大气治理等方面用途非常广泛。
I.工业上可以采用热还原法制备金属镁(沸点1107℃,熔点648.8℃)。 将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先 升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体)。
(1)用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是____________。
(2)碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:_____________。

II.工业上利用纳米MgH2和LiBH4组成的体系储放氢(如题图所示)。

(3)写出放氢过程中发生反应的化学方程式:___________。
III.工业上MgO浆液是高活性的脱硫剂,常用来脱除烟气中的SO2。主要包含的反应有: ① Mg(OH)2+ SO2=MgSO3+H2O ② MgSO3+SO2+H2O= Mg(HSO3)2 ③ Mg(HSO3)2+ Mg(OH)2=2MgSO3+2H2O ④ 2MgSO3+O2=2MgSO4
脱硫时,MgO的脱硫效率、pH及时间的关系如题图所示。

己知20℃时,H2SO3的K1=l.54×10-2,K2=1.02×10-7,25℃时,Ksp[MgSO3]= 3.86×10-3,Ksp(CaSO3)= 3.1×10-7。
(4)脱硫过程中使浆液pH减小最显著的反应是______________(填①、②、③或④)。
(5)约9000s之后,脱硫效率开始急速降低,其原因是______________。
(6)其他条件相同时,镁基和钙基脱硫效率与液、气摩尔流量比如题图所示。镁基脱硫效率总比钙基大,除生成的MgSO4具有良好的水溶性外,还因为______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com