
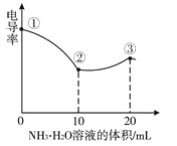
����Ŀ���ⶨ��Һ�絼�ʵı仯�Ƕ����о����������Һ�з�Ӧ���ɵ�һ�ַ�������Һ�絼��Խ���䵼������Խǿ�������£���0.100molL-1��NH3H2O�ζ�10.00mLŨ�Ⱦ�Ϊ0.100molL-1HCl��CH3COOH�Ļ����Һ�����õ絼��������ͼ��ʾ������˵����ȷ���ǣ� ��
A.�ٵ���Һ��pH���
B.��Һ�¶ȣ��ٸ��ڢ�
C.�۵���Һ�У�c(Cl-)��c(CH3COO-)
D.�ڵ���Һ�У�c(NH4+)+c(NH3H2O)��c(CH3COOH)+c(CH3COO-)
���𰸡�C
��������
�����£���0.100molL-1��NH3H2O�ζ�10.00mLŨ�Ⱦ�Ϊ0.100molL-1HCl��CH3COOH�Ļ����Һ��NH3H2O����HCl������Ӧ�����Ȼ�狀�ˮ�������ƶ�������Ŀ���䵫��Һ������絼���½�������10mLNH3H2O��NH3H2O��CH3COOH��Ӧ���ɴ���狀�ˮ������Ϊ������ʶ������Ϊǿ����ʣ��ʷ�Ӧ����Һ�������ƶ�����Ũ�����ӣ��絼�����ߡ�
A�����㴦Ϊ0.100molL-1HCl��CH3COOH�Ļ����Һ������NH3H2O�ĵ��룬pH�����ߣ�A����
B������к�Ϊ���ȷ�Ӧ������Һ�¶�Ϊ������������B����
C����������Ϊ�����ʵ������Ȼ�狀ʹ���泥������������Ϊ��������ӣ�Ҫ����ˮ�⣬��������Һ�У�c(Cl-)��c(CH3COO-)��C��ȷ��
D�����㴦����һˮ�ϰ������ʵ�������Һ�еĴ�������ʵ�����ͬ������Ԫ���غ��֪��c(NH4+)+c(NH3H2O)=c(CH3COOH)+c(CH3COO-)��D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3����ѧʵ���ҳ��õ��Լ���
��1��д���Ȼ�����ˮ�еĵ��뷽��ʽ��_________��
��2�������Ȼ�����Һ�Ʊ������������塣
�������Ʊ�������������IJ���������ȷ����_______������ĸ����
A.���Ȼ�����Һ�еμ���������������ϡ��Һ
B.��������Ȼ���������Һ
C.�ڰ�ˮ�еμ��Ȼ���Ũ��Һ
D.�ڷ�ˮ�еμӱ����Ȼ�����Һ����������ֺ��ɫҺ��
�������Ȼ�����Һ��������������ķ�����___________��
��3��Ϊ��̽�����ӷ�Ӧ�ı��ʣ��������ʵ�飺
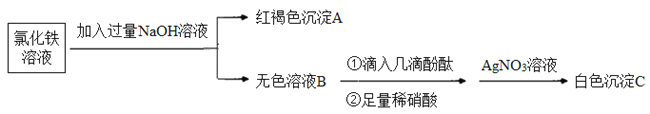
��д������A�����ӷ���ʽ��_________��
�����������У���������ϡ�����Ŀ����________������ж���ɫ��ҺB��ϡ���ᷢ�������ӷ�Ӧ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ü�����ϩʱ����Ҫ���ӵ���

��ϩ���Ʊ� | �Լ�X | �Լ�Y | |
A | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | KMnO4������Һ |
B | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | Br2��CCl4��Һ |
C | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | KMnO4������Һ |
D | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | Br2��CCl4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȼ�ϵ����CsHSO4����Ϊ����ʴ���H+��������ṹ����ͼ������ܷ�Ӧ�ɱ�ʾΪ��2H2+O2=2H2O�������й�˵����ȷ����
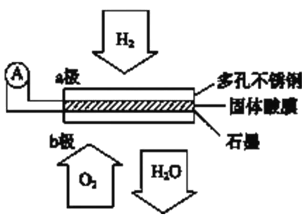
A. ����ͨ�����·��b������a��
B. b���ϵĵ缫��ӦʽΪ��O2+2H2O+4e--=4OH--
C. ÿת��0.1mol���ӣ�����1.12L��H2
D. H+��a��ͨ�����������ʴ��ݵ�b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W�����ֳ����Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ϵ��ͼ��ʾ����֪X��ԭ�Ӱ뾶������ԭ������С��Y��һ�ֺ��ص�������Ϊ15��������Ϊ8��W������������ˮ�����ں�������������ǿ������˵������ȷ����(����)

A. XԪ���ж��ֺ���
B. X��Y���γ�YX3���ۻ�����
C. YԪ�صĵ縺��һ��С��ZԪ��
D. WԪ�صĵ�����ǿ�����ԣ�����������ˮ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ��������������ռ���Һ��װ����ͼ��ʾ������������������Ϊ���Ե缫�����ͬ��ͬѹ�£�������������ҵ������ԼΪ1��2������˵����ȷ����(����)
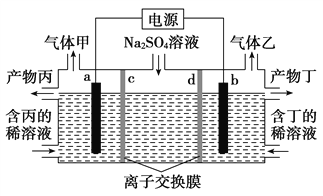
A. a�����Դ�ĸ�������
B. ���������
C. ���ӽ���ĤdΪ�����ӽ���Ĥ
D. a�缫��Ӧʽ��2H2O��2e��===H2����2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijNa2CO3��NaHCO3�Ļ����Һ����μ���BaCl2��Һ����Һ��lgc(Ba2+)��![]() �ı仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
�ı仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
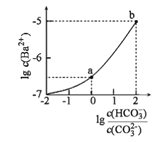
(��֪��H2CO3��Ka1��Ka2�ֱ�Ϊ4.2��10-7��5.6��10-11)
A.a��Ӧ��Һ��pHС��b
B.b��Ӧ��Һ��c(H+)=4.2��10-7mol��L-1
C.a��b��Ӧ����Һ��![]() ��С
��С
D.a��Ӧ����Һ��һ�����ڣ�2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3-)+c(Cl-)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ü�����ϩʱ����Ҫ���ӵ���

��ϩ���Ʊ� | �Լ�X | �Լ�Y | |
A | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | KMnO4������Һ |
B | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | Br2��CCl4��Һ |
C | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | KMnO4������Һ |
D | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | Br2��CCl4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������������Ϊ2.0 L�ĺ����ܱ������з������·�Ӧ��PCl5(g)PCl3(g)��Cl2(g)
��� | �¶�(��) | ��ʼ���ʵ��� (mol) | ƽ�����ʵ��� (mol) | �ﵽƽ������ʱ�� (s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
�� | 320 | 0.40 | 0.10 | 0.10 | t1 |
�� | 320 | 0.80 | t2 | ||
�� | 410 | 0.40 | 0.15 | 0.15 | t3 |
����˵����ȷ����
A.ƽ�ⳣ��K��������������
B.��Ӧ����ƽ��ʱ��PCl5��ת���ʣ�������������
C.��Ӧ����ƽ��ʱ���������е�ƽ������Ϊv(PCl5)=![]() mol/(L��s)
mol/(L��s)
D.��ʼʱ���������г���PCl5 0.30mol��PCl3 0.45 mol��Cl2 0.15 mol����Ӧ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com