
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol/(L·s)
mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30mol、PCl3 0.45 mol和Cl2 0.15 mol,则反应将向逆反应方向进行
【答案】BD
【解析】
A.I、Ⅱ温度相同,则二者平衡常数相等,Ⅲ比I相比温度升高,平衡时Ⅲ中PCl3比I中的大,说明升高温度平衡正向移动,平衡常数增大,故平衡常数K:容器Ⅱ<容器Ⅲ,故A错误;
B.恒温恒容下,Ⅱ等效在I中平衡基础上压强增大一倍,平衡逆向移动,转化率减小,PCl5的转化率:容器Ⅱ<容器Ⅰ,故B正确;
C.速率之比等于化学计量数之比,则v(PCl5)=v(PCl3)=![]() =
=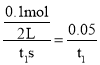 mol/(Ls),故C错误;
mol/(Ls),故C错误;
D.410℃平衡时PCl5为0.4mol0.15mol=0.25mol,该温度下平衡常数K=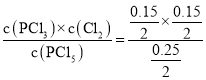 =0.045,浓度商Qc=
=0.045,浓度商Qc=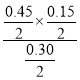 =0.1125>K=0.045,反应向逆反应进行,故D正确;
=0.1125>K=0.045,反应向逆反应进行,故D正确;
答案选BD。


科目:高中化学 来源: 题型:
【题目】测定溶液电导率的变化是定量研究电解质在溶液中反应规律的一种方法,溶液电导率越大其导电能力越强。室温下,用0.100molL-1的NH3H2O滴定10.00mL浓度均为0.100molL-1HCl和CH3COOH的混合溶液,所得电导率曲线如图所示。下列说法正确的是( )
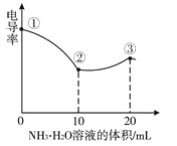
A.①点溶液:pH最大
B.溶液温度:①高于②
C.③点溶液中:c(Cl-)>c(CH3COO-)
D.②点溶液中:c(NH4+)+c(NH3H2O)>c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是(已知酮基只与氢气加成,与Br2不反应)( )
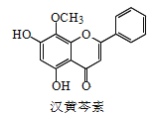
A.汉黄芩素的分子式为C16H13O5
B.该物质遇FeCl3溶液显色
C.1mol该物质与溴水反应,最多消耗1molBr2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的是
A. 新制氯水光照后颜色变浅
B. 2HI(g)![]() H2(g)+I2(g)平衡体系,加压颜色变深
H2(g)+I2(g)平衡体系,加压颜色变深
C. 高压比常压有利于合成氨
D. 钠与氯化钾共融制备钾Na(1)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下:
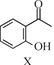 +
+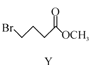
![]()

下列说法正确的是
A.物质X在空气中易被氧化
B.物质Z与氢气完全加成后的物质中含有3个手性碳原子
C.物质Y能发生取代、消去、加成反应
D.等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质既不属于同系物,也不属于同分异构体的是( )
A.CH3-CH2-CH3和CH3-CH2-CH2-CH3
B.CH3CH2CH=CH2和![]()
C.![]() 和
和![]()
D.乙酸和甲酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
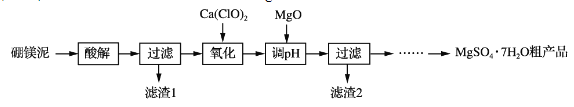
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是
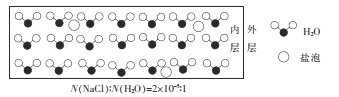
A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.每含1mol H2O的海冰内就有2×l0-5 NA个NaCl分子(NA为阿伏加德罗常数)
D.海冰内层NaCl的浓度约为l0-3 mol/L(设冰的密度为0.9 g.cm-3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是( )
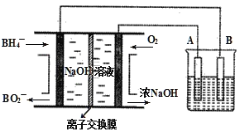
A.离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B.该燃料电池的负极反应式为BH4+8OH--8e-=BO2-+6H2O
C.电解池中的电解质溶液可以选择CuCl2溶液
D.每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com