
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2含有的原子数为NA
B. 等质量的O2和O3中所含的氧分子数相同
C. 常温常压下,14g N2含有电子数为7NA
D. 等质量的CO与CO2中所含碳原子数之比为7﹕11
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是( )

A. 该装置中电能转化为光能
B. 电路中每转移0.2mol电子,甲池溶液质量变化 3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中碳棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为___________。
(2)在CH2=CHCN中,碳原子的杂化方式有___________、___________,所含σ键数目和π键数目之比为___________。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小___________(由大到小,用H一R—H表示),其原因是___________。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是___________。
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20 (1=10-8cm),则C60的晶体密度为___________g/cm3。
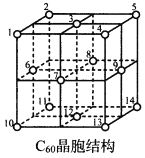
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有___________个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组研究了其他条件不变时,改变条件对可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0的影响。下列说法正确的是
2SO3(g) ΔH<0的影响。下列说法正确的是

A. 图1研究的是温度、压强对平衡的影响,横轴表示压强
B. 图2研究的是温度对平衡的影响,Ⅱ采用的温度更低
C. 图3中t0时使用了催化剂,使平衡向正反应方向移动
D. 图4中t0时增大压强,使平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生如下反应:mX(g)![]() nY(g) ΔH=QKJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法不正确的是
nY(g) ΔH=QKJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法不正确的是

A. 温度不变,压强增大,Y的质量分数减小
B. m>n
C. Q<0
D. 体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某双原子分子构成的气体,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA。对质量为m g的该气体,求:(用含M、NA、m符号的式子表示)。
(1)在标准状况下,该气体的体积为________L,密度为________g·L-1。
(2)该气体所含的原子总数为________个。
(3)该气体的一个分子的质量约为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6. 4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是____________________;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)= __________;
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
|
|
图1 | 图2 |
①该小组同学提出的假设是__________________________________________;
②请你帮助该小组同学完成实验方案,并填完表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | 向试管中加入少量固体 | ||
4 | 3.0 | 2.0 | 3.0 | 2.0 | _____________ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中发生可逆反应A(g)+3B(g) ![]() 2C(g),下列叙述一定是达到平衡的标志的是
2C(g),下列叙述一定是达到平衡的标志的是
①2υ(B)正=3υ(C)逆;②单位时间内生成a mol A,同时消耗2a mol C;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤C的质量分数不再改变;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态;⑦A、B、C的浓度彼此相等;⑧混合气体的密度不再改变的状态
A. ①③④⑤ B. ①④⑤⑦ C. ④⑤⑥⑧ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,雾霾天气多次肆虐全国各地。其中,燃煤的烟道气和汽车尾气中含有的氮氧化合物是造成空气污染的原因之一。
(1)用CH4催化还原氮氧化物。已知CH4 (g)+2O2 (g)=CO2 (g)+2H2O (l);ΔH1=a kJ/mol,欲计算反应CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变ΔH2 , 则还需要查找某化合反应的焓变ΔH3,当反应中各物质化学计量数之比为最简整数比时 ΔH3 = b kJ/mol,则该反应的热化学方程式为____________________。据此计算出ΔH2 =_______kJ/mol(用含a和b的式子表示)。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s) + 2NO(g)![]() N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
① T1℃时,该反应的平衡常数K=___________(保留两位小数)。
② 30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________________。
③ 若30 min后升高温度至T2℃/span>,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的ΔH____________0(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com