
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为___。与砷同周期的主族元素的基态原子中,电负性最大的为____(填元素符号)。
(2)![]() 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______。
②其中阴离子的VSEPR模型为_____,与其互为等电子体的分子为_____(只写一种分子式即可)。
(3)M(![]() )可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
)可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为______。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______。
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ=____g·cm-3。
,该晶体的密度ρ=____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁子香酚可用于制备杀虫剂和防腐剂,结构简式如右下图所示。下列说法中,不正确的是

A. 丁子香酚可通过加聚反应生成高聚物
B. 丁子香酚分子中的含氧官能团是羟基和醚键
C. 1 mol丁子香酚与足量氢气加成时,最多能消耗4 mol H2
D. 丁子香酚能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是

A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X、Y和高聚物Z,可以用烃A为主要原料,采用以下路线:

已知:I.反应①、反应②均为加成反应。
II.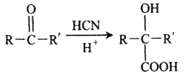
请回答下列问题:
(1)A的结构简式为_____________。
(2)Z中的官能团名称为____________,反应③的条件为___________.
(3)关于药物Y(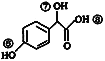 )的说法正确的是____________。
)的说法正确的是____________。
A.1mol药物Y与足量的钠反应可以生成33.6 L氢气
B.药物Y的分子式为C8H8O4,能使酸性高锰酸钾溶液褪色
C.药物Y中⑥、⑦、⑧三处-OH的活泼性由强到弱的顺序是⑧>⑥>⑦
D.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4 mol和2 mol
(4)写出反应E→F的化学方程式______________________________________。F→X的化学方程式______________________________________________。
(5)写出符合下列条件的E的一种同分异构体的结构简式_______________。
①遇FeCl3溶液可以发生显色反应,且是苯的二元取代物;
②能发生银镜反应和水解反应;
③核磁共振氢谱有6个峰。
(6)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选设计合成Z的线路___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。
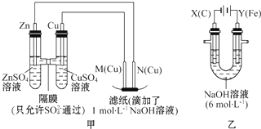
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电板(铁电极)质量减小0.28g,则在Y极收集到气体为____mL(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A.该电池工作时,每消耗![]()
![]() 转移3mol电子
转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,![]() 向电极B移动
向电极B移动
D.电极B上发生的电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的元素定量分析最早是由德国人李比希提出的,某实验室模拟李比希法测定某种氨基酸(CxHyOzNp)的分子组成。取一定量的该氨基酸放在纯氧气中燃烧,燃烧后生成的水用装置D(无水氯化钙)吸收,二氧化碳用装置C(KOH浓溶液)吸收,N2的体积用E装置进行测量,所需装置如下图(夹持仪器的装置及部分加热装置已略去):

(1)该实验装置的合理连接顺序为:A、__、E。(部分装置可以重复选用)
(2)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是_____。
(3)A中放入CuO的作用是_______,装置B的作用是_____。
(4)为了确定此氨基酸的分子式,除了准确测量N2的体积、生成二氧化碳和水的质量外,还需得到的数据有___。
(5)在读取E装置中所排水的体积时,液面左低右高,则所测气体的体积____(填“偏大”、“偏小”或“无影响”)。
(6)已知分子式为C2H4O2的有机物也含有氨基酸中的某个官能团,请设计实验证明该官能团(试剂任选):____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com