
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A.该电池工作时,每消耗![]()
![]() 转移3mol电子
转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,![]() 向电极B移动
向电极B移动
D.电极B上发生的电极反应为:![]()
科目:高中化学 来源: 题型:
【题目】某化学实验小组用如图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。

回答下列问题:
(1)开始实验之前要进行的操作是__。
(2)写出利用装置I制取氨气的化学方程式__。
(3)按照a、f、e、b、c、d的顺序将仪器连接,装置Ⅲ中倒置漏斗的作用是__,装置IV中仪器的名称为__,盛装的试剂为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述正确的是( )
A.次氯酸的电子式:![]()
B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(1)△H=-57.3kJmol
C.H2S电离的方程式为:H2S![]() 2H++S2-
2H++S2-
D.标准状况下,1.12L![]() 和1.12L
和1.12L ![]() ,均含有0.1NA个氧原子
,均含有0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )

A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯的透光率良好,可制作挡风玻璃、眼镜片等。某聚碳酸酯(M)的合成路线如下:
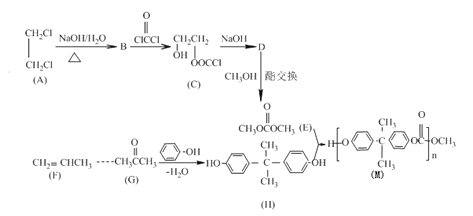
已知:
Ⅰ.D的分子式为C3H4O3,核磁共振氢谱只有一组峰
Ⅱ.R1COOR2+R3OH![]() R1COOR3+ R2OH
R1COOR3+ R2OH
(1)A的名称是 _______,D的结构简式为_____;
(2)B→C的反应类型______;
(3)关于H的说法正确的是(_______)
A.分子式为C15H16O2
B.呈弱酸性,是苯酚的同系物
C.分子中碳原子可能共面
D.1mol H与浓溴水取代所得有机物最多消耗NaOH10mol
(4)写出A→B化学方程式________;
(5)最常见的聚碳酸酯是用H与光气(![]() )聚合得到,请写出该聚碳酸酯的结构简式________;
)聚合得到,请写出该聚碳酸酯的结构简式________;
(6)H的同分异构体中满足下列条件的有___种;
①有萘环(![]() )结构 ②能发生水解和银镜反应 ③两个乙基且在一个环上
)结构 ②能发生水解和银镜反应 ③两个乙基且在一个环上
(7)F→G需三步合成
CH2=CHCH3![]() K
K![]() L
L
若试剂1为HBr,则L的结构简式为_______,③的反应条件是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如图所示。其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍。
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称:_______,X、Z单质构成燃料电池时正极参加反应的物质________(填化学式)反应类型为________(填氧化反应或还原反应)
(2)Q2Z电子式为__________,Q2Z2含的化学键类型为______________________。
(3)R、Z分别形成的简单离子的半径大小:________(用离子符号表示)。
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光催化技术是一种在能源和环境领域有着重要应用前景的绿色技术。Ti 的某种晶型的氧化物,M可用作光催化材料。
(1)基态Ti原子的价层电子排布图为___________。
(2)在第四周期d区元素中,与 Ti 原子未成对电子数相同的元素名称是___________。
(3)金属钛的原子堆积方式如图 1所示,则金属钛晶胞俯视图为_______。距离每个钛原子最近且等距的钛原子有________个。

(4)生活环境中的臭气源有氨气、甲硫醇(CH3-SH) 等,氧化物 M 可以作为高效除臭剂。与氨气互为等电子体的阳离子为 ________,甲硫醇中硫原子采取的杂化方式为_________,与S位于同一周期,且第一电离能小于S的非金属元素符号为_________,已知甲硫醇熔沸点小于甲醇(CH3OH),试解释此差异的主要原因_______。
(5)M的晶胞结构如图2,M 的化学式为___________。
(6)石墨烯是单个原子厚度的二维碳纳米材料(如图3),其比表面积大(比表面积指单位质量物料所具有的总面积)。石墨烯与M的结合使用,极大地提高了M的光催化效果。在石墨烯晶体中,每个最小的六元环占有______个C原子。已知石墨烯中C-C键长为 apm,则单层石墨烯的比表面积为______m2/g(NA表示阿伏伏德罗常数的数值,忽略碳原子的厚度)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com