
【题目】某化学实验小组用如图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。

回答下列问题:
(1)开始实验之前要进行的操作是__。
(2)写出利用装置I制取氨气的化学方程式__。
(3)按照a、f、e、b、c、d的顺序将仪器连接,装置Ⅲ中倒置漏斗的作用是__,装置IV中仪器的名称为__,盛装的试剂为__。
【答案】检验装置气密性 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 防止倒吸 球形干燥管 碱石灰
CaCl2+2H2O+2NH3↑ 防止倒吸 球形干燥管 碱石灰
【解析】
由实验目的可知,装置I用于制取氨气,装置IV中盛有的碱石灰,目的是用于干燥氨气,装置Ⅱ是用向下排空气法收集氨气,装置Ⅲ中倒置漏斗的作用是防止氨气溶于水产生倒吸,则装置的连接顺序为I、IV、Ⅱ、Ⅲ,仪器接口的连接顺序为a、f、e、b、c、d。
(1)与气体有关的实验,实验前进行的操作是检验装置气密性,本实验的目的是装置制取、收集纯净干燥的氨气,则实验前要进行的操作是检验装置气密性,故答案为:检验装置气密性;
(2)装置I中氯化铵固体与氢氧化钙固体共热反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(3)由于氨气极易溶于水,装置Ⅲ中倒置漏斗的作用是防止氨气溶于水产生倒吸;装置IV中仪器的名称为球形干燥管,其中盛有的碱石灰用于干燥氨气,故答案为:防止倒吸;球形干燥管;碱石灰。


科目:高中化学 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
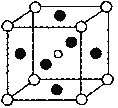
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为___。与砷同周期的主族元素的基态原子中,电负性最大的为____(填元素符号)。
(2)![]() 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______。
②其中阴离子的VSEPR模型为_____,与其互为等电子体的分子为_____(只写一种分子式即可)。
(3)M(![]() )可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
)可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为______。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______。
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ=____g·cm-3。
,该晶体的密度ρ=____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用电解法从溶液中去除。电解装置如图:以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷。
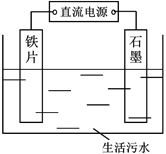
I.电解除氮
(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,相应的电极反应式为:_______。
(2)有Cl-存在时,除氮原理如图1所示,主要依靠有效氯(HClO、ClO-)将NH4+ 或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度如图2:
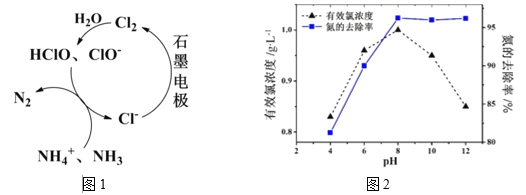
①当pH<8时,主要发生HClO氧化NH4+ 的反应,其离子方程式为:____________。
②结合平衡移动原理解释,当pH<8时,氮的去除率随pH的降低而下降的原因是:_____。
③当pH>8时,ClO-发生歧化导致有效氯浓度下降,而氮的去除率却并未明显下降,可能的原因是(答出一点即可):______。
II.电解除磷
(3)除磷的原理是利用Fe2+ 将PO43- 转化为Fe3(PO4)2沉淀。
①用化学用语表示产生Fe2+的主要过程:_______________。
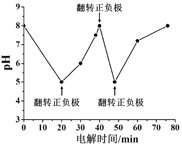
②如图为某含Cl- 污水在氮磷联合脱除过程中溶液pH的变化。推测在20-40 min时脱除的元素是________。
(4)测定污水磷含量的方法如下:取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-=AgSCN↓,共消耗c mol/LNH4SCN溶液V mL。则此污水中磷的含量为___mg/L(以磷元素计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在1~18号元素中,除稀有气体元素外,原子半径最大的是元素是__________,电负性最大的元素是__________(用元素符号表示)。
(2)某元素的![]() 轨道上有1个未成对电子,该元素为__________(用元素符号表示)。
轨道上有1个未成对电子,该元素为__________(用元素符号表示)。
(3)某元素原子的价电子排布式为![]() ,它在周期表中的位置是__________,其最高正化合价是__________。
,它在周期表中的位置是__________,其最高正化合价是__________。
(4)某元素的激发态(不稳定状态)原子的电子排布式为![]() ,该元素基态原子的电子排布式为__________。
,该元素基态原子的电子排布式为__________。
(5)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素.该元素的外围电子排布为![]() 该元素的名称为__________,它在元素周期表中位于__________区。
该元素的名称为__________,它在元素周期表中位于__________区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新化学键形成的过程。化学键的键能是两个原子间形成1 mol化学键时释放的能量或断开1 mol化学键所吸收的能量。
现提供以下化学键的键能:(kJ·mol1)P—P:198 P—O:360 O==O:498 P==O:585。
则P4(白磷)+5O2![]() P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图
P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图 ,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁子香酚可用于制备杀虫剂和防腐剂,结构简式如右下图所示。下列说法中,不正确的是

A. 丁子香酚可通过加聚反应生成高聚物
B. 丁子香酚分子中的含氧官能团是羟基和醚键
C. 1 mol丁子香酚与足量氢气加成时,最多能消耗4 mol H2
D. 丁子香酚能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A.该电池工作时,每消耗![]()
![]() 转移3mol电子
转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,![]() 向电极B移动
向电极B移动
D.电极B上发生的电极反应为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com