
| A、2:3 | B、1:7 |
| C、3:5 | D、2:7 |


科目:高中化学 来源: 题型:
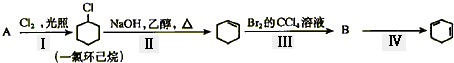 ( )
( )| A、物质A的分子式为C6H6 |
| B、线路中的一氯环己烷为氯代芳香烃 |
C、产物 能使酸性高锰酸钾溶液褪色 能使酸性高锰酸钾溶液褪色 |
| D、步骤Ⅳ的反应类型为水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
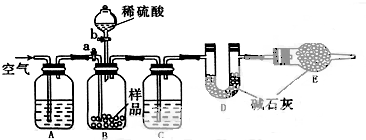
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期非金属元素含氧酸的酸性从左到右依次增强(除Ar外) |
| B、形成离子键的阴阳离子间只存在静电吸引力 |
| C、HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| D、元素周期律是元素原子核内核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
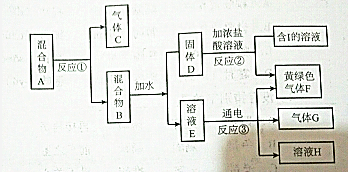
查看答案和解析>>
科目:高中化学 来源: 题型:

 (1,2二溴乙烷),由A转化为B的化学方程式为
(1,2二溴乙烷),由A转化为B的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com