
| A、0.4Q1+0.15Q2 |
| B、0.2Q1+0.05Q2 |
| C、0.2Q1+0.15Q3 |
| D、0.2Q1+0.3Q2 |
| V |
| Vm |
| 11.2L |
| 22.4L/mol |
| 2 |
| 5 |
| 0.3mol |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Fe(NO3)2溶液中滴加稀硫酸 |
| B、将盐酸滴入NaAlO2溶液中 |
| C、向碳酸氢钠溶液中滴加氢氧化钠溶液 |
| D、加热溶有SO2的品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(A-)=c(K+) |
| B、c(H+)=c(OH-)<c(K+)<c(A-) |
| C、V总≥20mL |
| D、V总≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A-M有如图转化关系.已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色.(有些反应条件已省略)
A-M有如图转化关系.已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色.(有些反应条件已省略)查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |

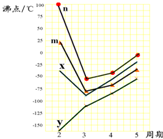
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com