
����Ŀ��A��B��C�����ֳ���������Ԫ�صĵ��ʡ�������DΪ��ɫҺ�壬E��һ�ֳ������������塣��ת����ϵ��ͼ����Ӧ�����Ͳ��ֲ�����ȥ�����Իش�:

��1��E�Ľṹʽ��____________��F�ĵ���ʽ��____________
��2��д��F��D��Ӧ�����ӷ���ʽ___________________________________________
��3������Z��B��Ϊͬ�������壬�������ڶԿ�������ɱ����������ˮ�����ʵȡ�Z�����Ե⻯����Һ��Ӧ����B�͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��_________________________________________________��
���𰸡� O=C=O ![]() 2Na2O2 +2H2O=4Na++4OH-+O2�� O3+2H++2I-=O2+I2+H2O
2Na2O2 +2H2O=4Na++4OH-+O2�� O3+2H++2I-=O2+I2+H2O
��������������DΪ��ɫҺ�壬��DΪH2O��E��һ�ֳ������������壬��EΪCO2����ת����ϵͼ�ɵã�AΪH2��BΪO2��CΪ̼���ʣ�FΪNa2O2��
��1��CO2Ϊֱ���η��ӣ��ṹʽΪO=C=O��Na2O2Ϊ���ӻ��������ʽΪ![]() ��
��
��2��FΪNa2O2��DΪH2O�����߷�Ӧ�����������ƺ����������ӷ���ʽΪ��2Na2O2 +2H2O=4Na++4OH-+O2����
��3��BΪO2��Z��B��Ϊͬ�������壬��ZΪO3�������Ե⻯����Һ��Ӧ����O2��I2����Ӧ�����ӷ���ʽΪO3+2H++2I-=O2+I2+H2O��


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����ʵ�鱨�����г������������к�������
A. ��10mL��Ͳ��ȡ7.13 mLϡ����
B. ��������ƽ����25.20g NaCl
C. �ù㷺pH��ֽ���ij��Һ��pHΪ2.3
D. ��25mL�ζ������к͵ζ�ʱ����ȥijŨ�ȵļ���Һ21.70mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������;�㷺����Ҫ��������Ӳ�ʻ����µĺϽ��Լ����ݵĵ�˿�������£����ܱ���������H2��ԭWO3�ɵõ������٣����ܷ�ӦΪ��WO3 (s) + 3H2 (g) ![]() W (s) + 3H2O (g)
W (s) + 3H2O (g)
��ش��������⣺
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ___________________________��
��2��ij�¶��·�Ӧ��ƽ��ʱ��H2��ˮ�����������Ϊ2:3����H2��ƽ��ת����Ϊ_____�����¶ȵ����ߣ�H2��ˮ����������ȼ�С����÷�ӦΪ��Ӧ_______��������������������������
��3�������ܷ�Ӧ���̴��·�Ϊ�����Σ�������Ҫ�ɷ����¶ȵĹ�ϵ���±���ʾ��
�¶� | 25�� ~ 550�� ~ 600�� ~ 700�� |
��Ҫ�ɷ� | WO3 W2O5 WO2 W |
��һ�η�Ӧ�Ļ�ѧ����ʽΪ_____________��
580��ʱ���������ʵ���Ҫ�ɷ�Ϊ________������WO3��ȫת��ΪW��������������H2���ʵ���֮��Ϊ____________��
��4����֪���¶ȹ���ʱ��WO2 (s)ת��ΪWO2 (g)��
WO2 (s) + 2H2 (g) ![]() W (s) + 2H2O (g)����H �� +66.0 kJ��mol��1
W (s) + 2H2O (g)����H �� +66.0 kJ��mol��1
WO2 (g) + 2H2(g) ![]() W (s) + 2H2O (g)����H �� ��137.9 kJ��mol��1
W (s) + 2H2O (g)����H �� ��137.9 kJ��mol��1
��WO2 (s) ![]() WO2 (g) ����H �� ______________________��
WO2 (g) ����H �� ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ� ��
A.10mL��������Ϊ98%��H2SO4 �� ��10mLˮϡ�ͺ�H2SO4��������������49%
B.����0.1mol/L��Na2CO3��Һ480mL������500mL����ƿ
C.�ڱ���£���22.4L��������1Lˮ�У��õ�1mol/L�İ�ˮ
D.ͬ��ͬѹ�£�20mLCH4��60mLO2������ԭ����֮��Ϊ5��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����пƬ����Ƭ����ʢ��ϡʳ��ˮ��K3[Fe��CN��6]��Һ�����Һ���������У���ͼ��ʾƽ��ͼ��������һ��ʱ�������˵������ȷ����

A. ��������ҺpH����
B. �������ܿ���������
C. ��������������ɫ����
D. �������ܿ������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ӡˢ��·��ʱ����FeCl3��Һ��Ϊ����ʴҺ����������ӦΪCu+2Fe3+�T2Fe2++Cu2+�����ݸ÷�Ӧ�ж�����˵������ȷ���ǣ� ��
A. Cu�ǻ�ԭ��B. Fe3+����������
C. �÷�Ӧ���û���ӦD. �÷�Ӧ�������ӷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij2 L�����ܱ������г���2 mol X��g����1 mol Y��g��������Ӧ��2X��g����Y��g��![]() 3Z��g������H����Ӧ�����г��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����
3Z��g������H����Ӧ�����г��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����
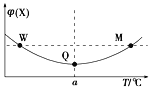
A. M��ʱ��Y��ת�������
B. W��M����Y������Ӧ�������
C. �����¶ȣ�ƽ�ⳣ����С
D. ƽ������Z�ﵽ��ƽ��ʱZ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���������ȷ�Ӧ����
A. ʵ�����Ʊ����� B. ���ȵ�̼��ˮ�ķ�Ӧ
C. Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ D. ��������������ĩ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г����ʫ�����䱾����ҪΪ��ѧ�仯����
A. ���Ƴ��� B. ���Ҹ�ȼ C. ѩ��ɽ������Ȫ D. ������ɳʼ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com