
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g) ![]() W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_______(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成份 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为_____________;
580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________。
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g) ![]() W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2(g) ![]() W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s) ![]() WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
【答案】 ![]() 60% 吸热 2WO3+H2=W2O5+H2O W2O5和WO2 1:1:4 +203.9kJ·mol-1
60% 吸热 2WO3+H2=W2O5+H2O W2O5和WO2 1:1:4 +203.9kJ·mol-1
【解析】(1)根据化学方程式及化学平衡常数的定义,K=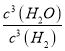 。
。
(2)设氢气的起始体积为a,变化体积为x,列三段式:
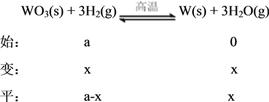
![]() =
=![]() ,解得x=0.6a,所以H2的平衡转化率为:0.6a÷a×100%=60%;温度升高,H2与水蒸气的体积比减小,说明升温平衡正向移动,正反应为吸热反应。
,解得x=0.6a,所以H2的平衡转化率为:0.6a÷a×100%=60%;温度升高,H2与水蒸气的体积比减小,说明升温平衡正向移动,正反应为吸热反应。
(3)由表中数据可知,第一阶段固体为WO3和W2O5,所以反应的化学方程式为;2WO3+H2![]() W2O5+H2O;由表中第二阶段主要成分与温度关系可知,580℃时,固体物质的主要成分为W2O5和WO2;假设有2molWO3,根据W原子守恒,由2WO3+H2=W2O5+H2O、W2O5+H2=2WO2+H2O、WO2+2H2=W+2H2O可知,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4。
W2O5+H2O;由表中第二阶段主要成分与温度关系可知,580℃时,固体物质的主要成分为W2O5和WO2;假设有2molWO3,根据W原子守恒,由2WO3+H2=W2O5+H2O、W2O5+H2=2WO2+H2O、WO2+2H2=W+2H2O可知,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4。
(4)给已知中两个反应分别编号为①和②,根据盖斯定律,①-②得:WO2(s)![]() WO2(g) ΔH=+66.0kJ·mol-1-(-137.9kJ·mol-1)= +203.9kJ·mol-1。
WO2(g) ΔH=+66.0kJ·mol-1-(-137.9kJ·mol-1)= +203.9kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】关于同温同压下等体积的CO2和CO,下列叙述:①质量相等;②密度相等;③所含分子数相等;④所含碳原子数相等,其中正确的是( )
A.①②③④ B.②③④ C.③④ D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]() xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
A. 5min内P的平均反应速率为0.15mol/(L·min)
B. Q的平衡浓度为1mol/L
C. Q的转化率为25%
D. x是2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)![]() 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
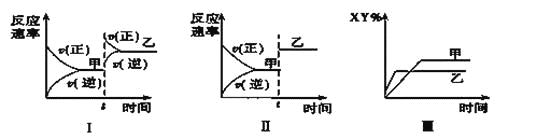
A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缺铁性贫血的人,需要补充含铁的无机盐,原因是
A.Fe2+是维持生命活动的重要物质B.Fe2+是血红蛋白的重要组成部分
C.Fe2+对维持细胞渗透压有重要的作用D.Fe2+是构成骨骼的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活,生产息息相关。下列有关物质用途及原理分析都正确且有相关性的是( )
选项 | 物质用途 | 原理分析 |
A | 液氨常作制冷剂 | 氨气分解生成N2和H2是吸热反应 |
B | 聚碳酸酯料替代聚乙烯作包装材料 | 聚碳酸酯塑料容易降解成小分子 |
C | 磁性氧化铁用于制造指南针 | Fe2O3具有磁性 |
D | 服用豆浆可缓解重金属中毒 | 重金属使蛋白质盐析 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的结构式是____________,F的电子式是____________
(2)写出F与D反应的离子方程式___________________________________________
(3)物质Z与B互为同素异形体,它常用于对空气进行杀菌、净化和水果保鲜等。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、F、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与D同主族,可形成DA型离子化合物,F、B与C同周期且相邻,C与E同主族,E2-与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广。请回答下列问题:
(1)W在元素周期表中的位置______________________;DA的电子式_______________
(2)A分别与C、E形成最简单化合物中沸点较高的是______________(填化学式),原因是_____________。
(3)A、C、D三种元素形成的物质中含有的化学键类型___________________,
(4)A、F、B、C四种元素形成化合物A8F2B2C4,其化学式为______________。
(5)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是_____________;生成沉淀的原因是_______________________________(用平衡移动原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com