
| A、饱和碳酸钠溶液 | B、氢氧化钠溶液 |
| C、苯 | D、水 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
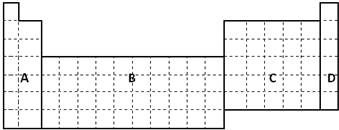
查看答案和解析>>
科目:高中化学 来源: 题型:
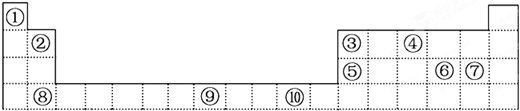
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向左移动 | B、向右移动 |
| C、达平衡状态 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:C3->D->B+>A2+ |
| B、原子序数:d>c>b>a |
| C、原子半径:A>B>D>C |
| D、原子的最外层电子数目:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、②③ | C、①④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、向正反应方向进行 |
| B、向逆反应方向进行 |
| C、达到平衡状态 |
| D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com