
【题目】短周期主族元素X、Y、Z、W、N的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y的次外层电子数是其电子总数的![]() ,离子化合物ZX2是一种储氢材料,W与Y属于同一主族,NY2是医学上常用的水消毒剂、漂白剂。下列叙述正确的是( )
,离子化合物ZX2是一种储氢材料,W与Y属于同一主族,NY2是医学上常用的水消毒剂、漂白剂。下列叙述正确的是( )
A.Y和W分别与X形成的简单化合物的热稳定性:X2Y>X2W
B.离子半径由小到大的顺序为Y2-<Z2+<N-<W2-
C.ZX2和NY2中化学键一致,且微粒个数之比均为1:2
D.含氧酸的酸性:N>W,可证明非金属性:N>W
【答案】A
【解析】
短周期主族元素X、Y、Z、W、N的原子序数依次增大,X的原子在元素周期表中原子半径最小,应为H元素,Y的次外层电子数是其电子总数的![]() ,则电子总数为8,应为O元素,W与Y属于同一主族,则W为S元素,N应为Cl元素,离子化合物ZX2是一种储氢材料,Z应为Mg元素,由以上分析可知X为H元素、Y为O元素、Z为Mg元素、W为S元素,N为Cl元素。
,则电子总数为8,应为O元素,W与Y属于同一主族,则W为S元素,N应为Cl元素,离子化合物ZX2是一种储氢材料,Z应为Mg元素,由以上分析可知X为H元素、Y为O元素、Z为Mg元素、W为S元素,N为Cl元素。
A.非金属性O>S,元素的非金属性越强,对应的氢化物热稳定性越稳定,故A正确;
B.简单离子具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径由小到大的顺序为:Mg2+<O2-<Cl-<S2-,故B错误;
C.MgH和ClO2中化学键分别为离子键和共价键,故C错误;
D.比较非金属性,根据最高价氧化物对应水化物的酸性判断,而含氧酸可能不是最高价氧化物的水化物,如HClO的酸性小于H2SO4,不能比较非金属性,故D错误。
答案为A。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图,其中T所处的周期序数与主族序数相等,下列叙述正确的是( )
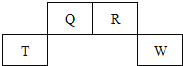
A.离子半径:Tm+>Wn-
B.非金属性:Q>W
C.R的简单氢化物的水溶液呈碱性
D.Q的氧化物都是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3在水中易分解。一定条件下,起始浓度均为0.0216mol/L的O3溶液,在不同的pH、温度下,发生分解反应,测得O3浓度减少一半所需的时间(t)如下表所示:

下列判断不正确的是
A. 实验表明,升高温度能加快O3的分解速率
B. pH增大能加速O3分解,表明OH-可以对O3的分解起催化作用
C. 在30℃、pH=4.0时,O3的分解速率为1.00×10-4mol/(L·min)
D. 据表中的规律可推知,O3在下列条件下的分解速率v(40℃、pH=3.0)>v(30℃、pH=7.0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法正确的是( )
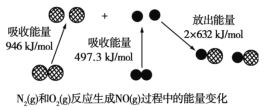
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接反应生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量
D.1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和 CO2 发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2 气体,反应过程中 CO2 气体和 CO 气体的浓度与时间的关系如图所示:

(1)t1 时,正、逆反应速率的大小关系为 v 正_____v 逆(填“>”“<”或“=”)。
(2)4 min 内,CO 的平均反应速率 v(CO)=_____。
(3)下列条件的改变能减慢其反应速率的是_____(填序号,下同)。
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是_____。
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2 的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表的一部分,根据A~I在周期表中的位置,回答以下问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是___________(用元素符号表示,本小题下同);除稀有气体外,原子半径最大的是___________,可用于制半导体材料的元素是_______;形成化合物中种类最多的元素是___________。
(2)最高价氧化物的水化物酸性最强的是___________(填化学式),A分别与D、E、F、G、H形成的化合物中,最稳定的是___________(填化学式)
(3)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别醮取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式___________
(4)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是基本有机化工原料,由乙炔制各聚乙烯醇和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
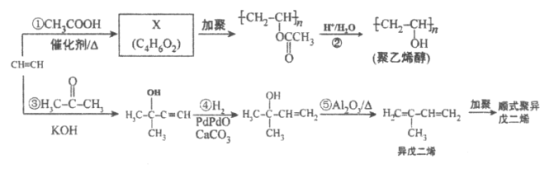
回答下列问题:
(1)按系统命名法命名异戊二烯:__________________________。
(2)写出X加聚的化学反应方程式_____________。
(3)反应①~③中,与反应④的反应类型不同的是_____________(填反应序号)反应⑤属于_____________反应。
(4)与乙炔具有相同官能团的异戊二烯的同分异构体共有_____________种。
(5)X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(选填字母)。
a. 质谱仪 b. 红外光谱仪 c. 元素分析仪 d. 核磁共振仪
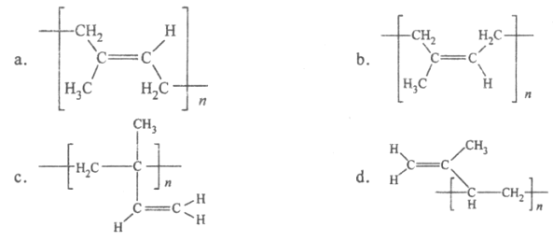
(6)顺式聚异戊二烯的结构式是(选填字母)_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com