
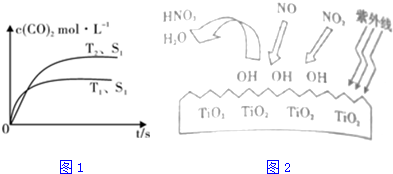
���� ��1���ٸ��ݵ���ƽ���ʱ���ж��¶ȸߵͣ�����ƽ��ʱ������̼��Ũ���ж��¶ȶ�ƽ���Ӱ�죬�����жϡ�H��
���������ı����S1��S2�������������������ѧ��Ӧ���ʣ���T2��S2�����µ���ƽ��ʱ���T2��S1��ʱ�����������Ӱ�컯ѧƽ���ƶ���ƽ��ʱ������̼��Ũ�Ȳ��䣻
������ͼ���֪NO��NO2����OH����ΪHNO3������ԭ���غ�ɵã�
��2������֪����CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867kJ/mol
��2NO2��g��?N2O4��g����H=-56.9kJ/mol
��H2O��g��=H2O��l����H=-44kJ/mol
���ݸ�˹���ɣ���-��+�ۡ�2�ɵã�CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��l����
��NH3��CO2���ʵ���Ϊ1��1������ʼ����Ϊ1 mol��NH3��ƽ��ת����Ϊx��������ʽ������NH3���������Ϊ20%��ʽ����ɵã�
����Һ�д���ƽ��NH3��H2O?NH4++OH-��������Һ��pHֵ������Һ��c��OH-��������������Ũ�ȼ���c��NH4+�������������غ������Һ��c��NH3��H2O��������NH3•H2O�ĵ��볣������ʽ���㣮
��� �⣺��1������ͼ��֪���¶�T1�ȵ���ƽ�⣬���¶�T1��T2���¶�Խ��ƽ��ʱ��������̼��Ũ��Խ�ͣ�˵�������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ������
���������ı����S1��S2�������������������ѧ��Ӧ���ʣ���T2��S2�����µ���ƽ��ʱ���T2��S1��ʱ�����������Ӱ�컯ѧƽ���ƶ���ƽ��ʱ������̼��Ũ�Ȳ��䣬��ͼ�л���c��CO2����T2��S2�����´ﵽƽ������еı仯����Ϊ��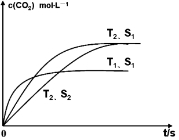 ��
��
�ʴ�Ϊ�� ��
��
����ͼ���֪NO��NO2����OH����ΪHNO3����ԭ���غ㣬NO+3OH�THNO3+H2O��
�ʴ�Ϊ��NO+3OH�THNO3+H2O��
��2������֪����CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867kJ/mol
��2NO2��g��?N2O4��g����H=-56.9kJ/mol
��H2O��g��=H2O��l����H=-44kJ/mol
���ݸ�˹���ɣ���-��+�ۡ�2�ɵã�CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��l������H=-898.1kJ/mol��
�ʴ�Ϊ��CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��l������H=-898.1kJ/mol��
��NH3��CO2���ʵ���Ϊ1��1������ʼ����Ϊ1 mol��NH3��ƽ��ת����Ϊx����������ʽ��
CO2��g��+2NH3��g��?��NH2��2CO��s��+H2O��g��
��ʼ����mol����1 1 0 0
ת������mol����0.5x x 0.5x 0.5x
ƽ������mol����1-0.5x 1-x 0.5x 0.5x
NH3���������Ϊ20%������$\frac{1-x}{1-0.5x+1-x+0.5x}$=20%�����x=75%��
�ʴ�Ϊ��75%��
�۸��ݵ���غ���c��NH4+��+c��H+��=c��Cl-��+c��OH-����������Һ�����ԣ���c��H+��=c��OH-��10-7mol/L����c��NH4+��=c��Cl-��=$\frac{1}{2}$��bmol•L-1=0.5bmol•L-1���ʻ�Ϻ���Һ��c��NH3��H2O��=$\frac{1}{2}$��amol•L-1-0.5bmol•L-1=��0.5a-0.5b��mol/L��NH3•H2O�ĵ��볣��Kb=$\frac{c��N{{H}_{4}}^{+}��•c��O{H}^{-}��}{c��N{H}_{3}•{H}_{2}O��}$=$\frac{0.5b��1{0}^{-7}}{0.5a-0.5b}$=$\frac{b��1{0}^{-7}}{a-b}$��
�ʴ�Ϊ��$\frac{b��1{0}^{-7}}{a-b}$��
���� ���⿼���˸�˹���ɡ���ѧƽ����йؼ��㣬Ӱ�컯ѧƽ������أ�����ƽ�ⳣ���ļ��㣬��ѧƽ�ⳣ�����йؼ����Ǹ߿��ȵ㣬Ҫ�������գ���һ�����Ѷȣ�ѧ��Ӧ���������Ŀ��Ϣ��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�¶�/K | 298 | 398 | 498 | �� |
| ƽ�ⳣ����K�� | 4.1��105 | K1 | K2 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/K | ��ӦI | ��Ӧ�� | ��֪�� K1��K2��K1�䣾K2�� |
| 298 | K1 | K2 | |
| 328 | K1�� | K2�� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
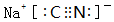 ��
��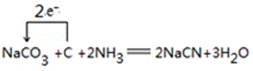 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
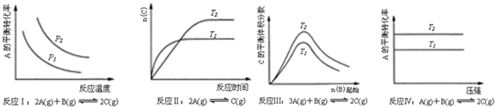
| A�� | ��Ӧ��H��0��P2��P1 | B�� | ��Ӧ��H��0��T1��T2 | ||
| C�� | ��Ӧ��H��0��T2��T1 | D�� | ��Ӧ������H��0��T2��T1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ƽ | B�� | ��ͷ�ι� | C�� | 250 mL����ƿ | D�� | ��Ͳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com