
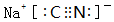 .
.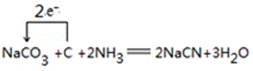 .
.分析 (1)Na原子核外有3个电子层、最外层电子数是1个电子,主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等;实验室少量的Na保存在煤油和石蜡中;
(2)NaCN中钠离子和氢氰根离子之间存在离子键、C-N原子之间存在共价键;
(3)①NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性;
②NaCN和双氧水反应生成一种酸式盐为碳酸氢钠,同时生成一种能使湿润的红色石蕊试纸变蓝色的气体为氨气;
③CN-+S2O32-=A+SO32-,根据原子守恒、电荷守恒确定A的化学式;
④纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2;
(4)在微粒中非金属性较强的元素显负价,非金属性较强的元素显正价,元素的非金属性越强,其最高价氧化物的水化物酸性越强,根据强酸制取弱酸判断非金属性强弱.
解答 解:(1)Na原子核外有3个电子层、最外层电子数是1个电子,主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,则Na位于第三周期第IA族;实验室少量的Na保存在煤油和石蜡中,
故答案为:第三周期第IA族;煤油或石蜡;
(2)NaCN中钠离子和氢氰根离子之间存在离子键、C-N原子之间存在共价键,NaCN电子式为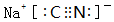 ,
,
故答案为: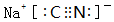 ;
;
(3)①NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性,水解离子方程式为CN-+H2O?HCN+OH-,
故答案为:CN-+H2O?HCN+OH-;
②NaCN和双氧水反应生成一种酸式盐为碳酸氢钠,同时生成一种能使湿润的红色石蕊试纸变蓝色的气体为氨气,离子方程式为CN-+H2O2+H2O=HCO3-+NH3↑,
故答案为:CN-+H2O2+H2O=HCO3-+NH3↑;
③CN-+S2O32-=A+SO32-,根据原子守恒、电荷守恒确定A的化学式为SCN-,
故答案为:SCN-;
④纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2,电子转移方向和数目为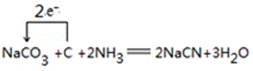 ,
,
故答案为: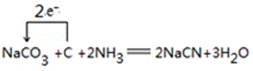 ;
;
(4)在微粒中非金属性较强的元素显负价,非金属性较强的元素显正价,所以非金属性N>C;元素的非金属性越强,其最高价氧化物的水化物酸性越强,根据强酸制取弱酸判断非金属性强弱,其检验方法为:取少量NaHCO3溶液于试管中,加入稀硝酸,有无色气泡生成,说明酸性HNO3>H2CO3,则非金属性N>C,
故答案为:>;取少量NaHCO3溶液于试管中,加入稀硝酸,有无色气泡生成,说明酸性HNO3>H2CO3,则非金属性N>C.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及非金属性强弱实验方案设计、氧化还原反应、化学用语等知识点,侧重考查学生知识综合运用能力,易错点是(4)题实验方案设计,注意化学用语的正确运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
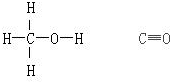
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低压强 | C. | 及时分离出Z | D. | 使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
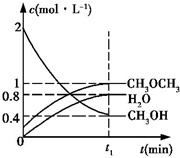 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
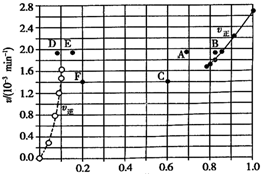 Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| l/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,则再次达到平衡时,相应点 可能分別是A、E | |
| B. | 若再次充人a molHI,则达到平衡时,相应点的播坐 标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,则再次达到平衡时,相应 点与改变条件前相间 | |
| D. | 若改变的条件是使用催化剂.则再次达到平衡时,相 应点与改变条件前不间. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
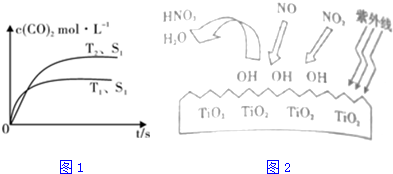
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
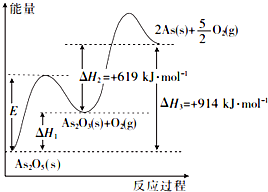 砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:
砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| B. | 原电池工作时负极质量一定减少 | |
| C. | 红热的铁与水蒸气反应生成氧化铁和氢气 | |
| D. | 石油的分馏属于物理变化,煤的干馏属于化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com