
| A. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| B. | 原电池工作时负极质量一定减少 | |
| C. | 红热的铁与水蒸气反应生成氧化铁和氢气 | |
| D. | 石油的分馏属于物理变化,煤的干馏属于化学变化 |
分析 A.二氧化硫通入到紫色石蕊溶液中,石蕊遇酸变红;
B.燃料电池的负极材料不变;
C.Fe与水蒸气反应生成四氧化三铁和氢气;
D.分馏与混合物的沸点有关,干馏为煤在隔绝空气条件下发生的复杂物理化学变化,生成煤焦油等.
解答 解:A.二氧化硫通入到紫色石蕊溶液中,石蕊遇酸变红,体现其酸性氧化物的性质,与漂白性无关,故A错误;
B.燃料电池的负极材料不变,则原电池的负极不一定减少,故B错误;
C.Fe与水蒸气反应生成四氧化三铁和氢气,四氧化三铁为黑色,故C错误;
D.分馏与混合物的沸点有关,干馏为煤在隔绝空气条件下发生的复杂物理化学变化,生成煤焦油等,前者为物理变化,后者为化学变化,故D正确;
故选D.
点评 本题考查物质的性质及反应原理,为高频考点,把握物质的性质、发生的反应、原电池等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
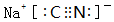 .
.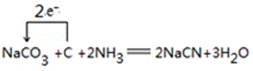 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘天平 | B. | 胶头滴管 | C. | 250 mL容量瓶 | D. | 量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
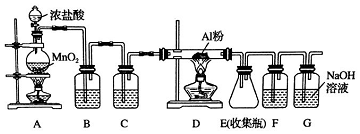
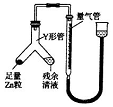
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2>I->Fe2+ | B. | I->Fe2+>SO2 | C. | Fe2+>I->SO2 | D. | Fe2+>SO2>I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
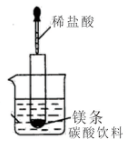 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com