
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ①②③ |
分析 根据N=nNA、分子构成计算分子数、原子总数、S原子个数、O原子个数,据此分析解答.
解答 解:根据N=nNA知,分子数与物质的量成正比,二者的物质的量相等,所以分子数相等;
二氧化硫分子中含有3个原子、三氧化硫分子中含有4个原子,所以二者原子数之比为3:4;
二氧化硫和三氧化硫分子中都只含1个S原子,所以二者含有相同的S原子;
每个二氧化硫分子中含有2个O原子、每个三氧化硫分子中含有3个O原子,所以O原子个数之比为2:3,
故选A.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生计算能力,明确物质的量公式及分子构成是解本题关键,注意物质的量公式的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
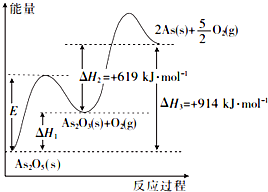 砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:
砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| B. | 原电池工作时负极质量一定减少 | |
| C. | 红热的铁与水蒸气反应生成氧化铁和氢气 | |
| D. | 石油的分馏属于物理变化,煤的干馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.5mol/L | D. | 2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,产生了白色沉淀,再加入足量的HCl溶液,沉淀不溶解,溶液中一定含有大量SO${\;}_{4}^{2-}$ | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀,加入盐酸可以产生无色且能使澄清石灰水变浑浊的气体,则该溶液不一定含有大量的CO${\;}_{3}^{2-}$ | |
| C. | 加入足量浓 NaOH溶液加热,产生了带有强烈刺激性气味的能使湿润的红色石蕊试纸变蓝的气体,溶液中一定含有大量的NH${\;}_{4}^{+}$ | |
| D. | 先加适量的硝酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
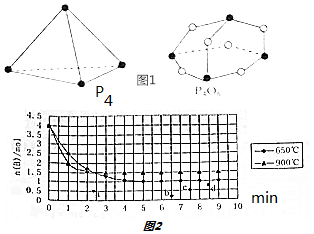
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com