
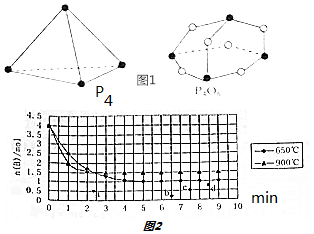
分析 (1)焓变等于反应物总键能-生成物总键能,据此计算P-P键的键能;
(2)镁离子沉淀时c(OH-)=$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{c(M{g}^{2+})}}$=$\sqrt{\frac{1.6×1{0}^{-11}}{1.6×1{0}^{-3}}}$mol/L=10-4 mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,pH=-lgc(H+);
(3)①升高温度平衡向吸热方向移动;
②反应达到平衡状态时△n(B)=(4-1)mol=3mol,根据方程式知,参加反应的△n(A)=△n(B)=3mol,从开始到平衡的反应速率v(A)=$\frac{\frac{△n}{V}}{△t}$;
③反应达到平衡状态时c(A)=$\frac{1.5mol}{2L}$=0.75mol/L,开始时c(A)=c(B)=$\frac{4mol}{2L}$=2mol/L,
该反应中A(g)+B(g)?M(g)+N(g)
开始(mol/L)2 2 0 0
反应(mol/L)1.25 1.25 1.25 1.25
平衡(mol/L)0.750.75 1.25 1.25
化学平衡常数K=$\frac{c(M).c(N)}{c(A).c(B)}$;
根据浓度商与化学平衡常数相对大小确定反应方向;
④若650℃时在同样容器中起始时充入的A和B的物质的量均为2mol,相当于减小压强平衡不移动,其转化率相等,但反应速率减小,反应达到平衡时间延长,达到平衡浓度是原来一半.
解答 解:(1)焓变等于反应物总键能-生成物总键能,设P-P键的键能为xkJ/mol,
6x+3×498-12×360=-1632,x=199,断键吸收热量,
故答案为:吸收;199;
(2)镁离子沉淀时c(OH-)=$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{c(M{g}^{2+})}}$=$\sqrt{\frac{1.6×1{0}^{-11}}{1.6×1{0}^{-3}}}$mol/L=10-4 mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,pH=-lgc(H+)=-lg10-10=10,
故答案为:10;
(3)①升高温度平衡向吸热方向移动,根据图知,升高温度B的物质的量增大,说明平衡逆向移动,则正反应是放热反应,故答案为:放热;
②反应达到平衡状态时△n(B)=(4-1)mol=3mol,根据方程式知,参加反应的△n(A)=△n(B)=3mol,从开始到平衡的反应速率v(A)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{3mol}{2L}}{4min}$=0.375mol/(L.min),
故答案为:0.375mol/(L.min);
③反应达到平衡状态时c(A)=$\frac{1.5mol}{2L}$=0.75mol/L,开始时c(A)=c(B)=$\frac{4mol}{2L}$=2mol/L,
该反应中A(g)+B(g)?M(g)+N(g)
开始(mol/L)2 2 0 0
反应(mol/L)1.25 1.25 1.25 1.25
平衡(mol/L)0.750.75 1.25 1.25
化学平衡常数K=$\frac{c(M).c(N)}{c(A).c(B)}$=$\frac{1.25×1.25}{0.75×0.75}$=2.78;
继续充入2molA、1molM和1molN,c(A)=0.75mol/L+$\frac{2mol}{2L}$=1.75mol/L、c(M)=c(N)=1.25mol/L+$\frac{1mol}{2L}$=1.75mol/L,
浓度商=$\frac{1.75×1.75}{1.75×0.75}$=2.3<2.78,平衡正向移动,
故答案为:2.78;正向;
④若650℃时在同样容器中起始时充入的A和B的物质的量均为2mol,相当于减小压强平衡不移动,其转化率相等,但反应速率减小,反应达到平衡时间延长,达到平衡浓度是原来一半,则c点是B物质平衡时对应的点,故答案为:c.
点评 本题考查化学平衡计算、难溶物溶解平衡等知识点,侧重考查学生图象分析、计算及综合知识灵活运用能力,会根据浓度商与化学平衡常数相对大小确定反应方向,注意(3)③可以等效为减小压强,注意白磷分子中含有6个P-P键而不是4个P-P键,为易错点,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:实验题
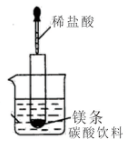 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
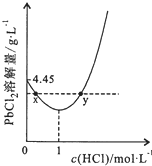 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com