
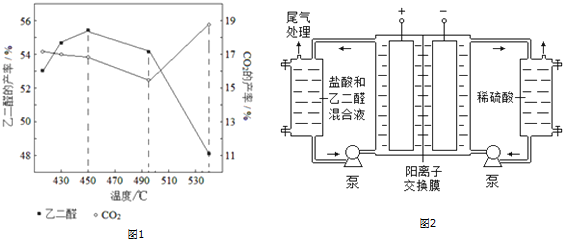
���� ��1������������ͭ����Ӧ������ȩ��ϡ���ᣬ���������Ҷ�ȩ��NO��ˮ�����ݷ�Ӧʽ����������д����ʽ��
�÷�Ӧ����Ҫ���и�ʴ�����ᣬ�������ж�����NO��
��2����OHC-CHO��g��+2H2��g��?HOCH2CH2OH��g����H=-78kJ•mol-1
2H2��g��+O2��g��?2H2O��g����H=-484kJ•mol-1
���ڶ�������ʽ��ȥ��һ������ʽ��HOCH2CH2OH��g��+O2��g��?OHC-CHO��g��+2H2O��g������H������Ӧ�ĸı䣬����ʽ�����ƽ�ⳣ�������
���¶����ߣ�ƽ�������ȷ����ƶ����¶ȴ���495�������̼��������
��3���õ����У������������ӷŵ����������������������ӷŵ�����������
��4����ǿ��Һ�����ԣ�
��� �⣺��1����Cu��NO3��2���£���ϡ����������ȩ��ȡ�Ҷ�ȩ�����ᱻ��ԭΪNO����Ӧ����ʽΪ��3CH3CHO+4HNO3$\frac{\underline{\;Cu��NO_{3}��_{2}\;}}{\;}$3OHC-CHO+4NO��+5H2O�����ڱȽ����Ե�ȱ���ǣ����ɵ�NO����Ⱦ����������ḯʴ�豸��
�ʴ�Ϊ��3CH3CHO+4HNO3$\frac{\underline{\;Cu��NO_{3}��_{2}\;}}{\;}$3OHC-CHO+4NO��+5H2O�����ɵ�NO����Ⱦ����������ḯʴ�豸��
��2����-OHC-CHO��g��+2H2��g��?HOCH2CH2OH��g����H=-78kJ•mol-1
2H2��g��+O2��g��?2H2O��g����H=-484kJ•mol-1
���ڶ�������ʽ��ȥ��һ������ʽ��HOCH2CH2OH��g��+O2��g��?OHC-CHO��g��+2H2O��g������H=��-484kJ•mol-1 ��-��-78kJ•mol-1 ��=-406kJ/mol����ѧƽ�ⳣ��K=$\frac{{K}_{2}}{{K}_{1}}$��
�ʴ�Ϊ��-406��$\frac{{K}_{2}}{{K}_{1}}$��
������ӦHOCH2CH2OH��g��+O2��g��?OHC-CHO��g��+2H2O��g��Ϊ���ȷ�Ӧ�������¶�ƽ�������ƶ����¶ȳ���495��ʱ���Ҷ�������ת��Ϊ������̼�ȸ����ʹ�Ҷ�ȩ���ʽ��ͣ�
�ʴ�Ϊ�������¶ȣ�����Ӧƽ�������ƶ����¶ȳ���495��ʱ���Ҷ�������ת��Ϊ������̼�ȸ����
��3�������������ӷŵ������������缫��ӦʽΪ2H++2e-=H2�����ʴ�Ϊ��2H++2e-=H2����
��4����ȩ��ˮ��Һ�����Խ�����Ϊ����ǿ��Һ���������������������Լ���ϡ���ᣬ
�ʴ�Ϊ����ǿ�����ԣ�
���� ���⿼����ԭ����������ԭ��Ӧ����˹���ɡ���������Ի�ѧƽ��Ӱ���֪ʶ�㣬���ؿ���ѧ��ͼ������жϼ������������ѵ��ǵ缫��Ӧʽ����д��ע�⣺��ѧ����ʽ���ʱ��ѧƽ�ⳣ����ˣ�����ʽ���ʱƽ�ⳣ���������Ŀ�ѶȲ���


 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȼ���BaCl2��Һ�������˰�ɫ�������ټ���������HCl��Һ���������ܽ⣬��Һ��һ�����д���SO${\;}_{4}^{2-}$ | |
| B�� | ����������CaCl2��Һ�������˰�ɫ����������������Բ�����ɫ����ʹ����ʯ��ˮ����ǵ����壬�����Һ��һ�����д�����CO${\;}_{3}^{2-}$ | |
| C�� | ��������Ũ NaOH��Һ���ȣ������˴���ǿ�Ҵ̼�����ζ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��Һ��һ�����д�����NH${\;}_{4}^{+}$ | |
| D�� | �ȼ����������Ὣ��Һ�ữ���ټ�AgNO3��Һ�������˰�ɫ��������Һ��һ�����д�����Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25��ʱ��0.1mol•L-1HF ��Һ��pH=1 | |
| B�� | Ksp��CaF2�����¶Ⱥ�Ũ�ȵı仯���仯 | |
| C�� | ����CaCl2��Һ����ϵ�е�c��H+������ | |
| D�� | ����ϵ��HF��CaCl2��Ӧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
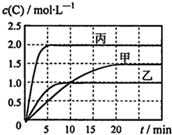 ��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A��g��+��B��g��?2C��g�����������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ����������C��Ũ����ʱ��仯��ϵ�ֱ��ñ���ͼ��ʾ��
��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A��g��+��B��g��?2C��g�����������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ����������C��Ũ����ʱ��仯��ϵ�ֱ��ñ���ͼ��ʾ��| ���� | �� | �� | �� |
| �ݻ� | 0.5L | 0.5L | 1.0L |
| �¶�/�� | T1 | T2 | T3 |
| ��Ӧ����ʼ�� | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A�� | ��ƽ��ʱA��g����Ũ�ȣ���=������ | |
| B�� | �������д�ƽ��ʱB��g����ת����Ϊ75% | |
| C�� | �¶ȷֱ�ΪT1��T2ʱ���÷�Ӧ��ƽ�ⳣ����K��T1����K��T2�� | |
| D�� | �������дﵽƽ�����ͬʱ���������ٳ���1mol A��g����1mol B��g����1molC��g������ƽ�����淴Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com