
分析 (1)长期放置在空气中的银制品,其表面会逐渐变黑,这是由于银和空气中的微量硫化氢发生了反应生成黑色的Ag2S;
(2)n(AgNO3)=0.05L×0.018mol/L=0.0009mol,n(HCl)=0.05L×0.020mol/L=0.001mol,硝酸银和HCl发生反应AgNO3+HCl=AgCl↓+HNO3,根据方程式知,HCl剩余,计算混合溶液中c(Cl-)、c(Ag+)、c(H+)溶液的pH=-lgc(H+);
(3)根据原电池中负极失电子发生氧化反应.
解答 解:(1)长期放置在空气中的银制品,其表面会逐渐变黑,这是由于银和空气中的微量硫化氢发生了反应生成黑色的Ag2S;
故答案为:Ag与空气中微量H2S反应生成黑色的Ag2S;
(2)n(AgNO3)=0.1L×0.018mol/L=0.0018mol,n(HCl)=0.01L×0.020mol/L=0.002mol,硝酸银和HCl发生反应AgNO3+HCl=AgCl↓+HNO3,根据方程式知,HCl剩余,混合溶液中c(Cl-)=$\frac{0.002-0.0018}{0.1+0.1}$mol/L=
=10-3 mol/L,溶液中c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{1{0}^{-3}}$mol/L,1.8×10-7mol/L;实际上氢离子不参加反应,则溶液中c(H+)=$\frac{0.002mol}{0.1L+0.1L}$═0.01mol/L,溶液的pH=-lgc(H+)=-lg0.01=2;
故答案为:1.8×10-7;2;
(3)负极使用的是高纯度锌片,以 ZnCl2和 NH4Cl 为主要电解质,负极失电子发生的反应为:Zn2++2e-=Zn;
故答案为:Zn2++2e-=Zn.
点评 考查氧化还原反应、pH计算、溶度积常数、原电池原理等知识点,综合性较强,明确溶度积常数含义、氧化还原反应本质等知识点即可解答,注意(2)题要进行过量计算,为易错点.


科目:高中化学 来源: 题型:解答题
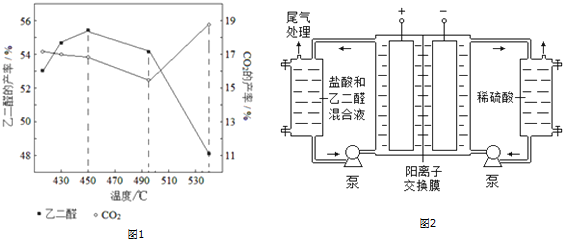
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
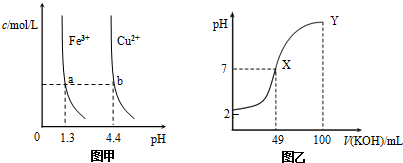
| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油 | B. | 馒头 | C. | 牛肉 | D. | 橙子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com