
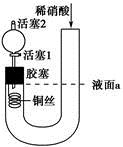
| A.关闭活塞1,加入稀硝酸至液面a处 |
| B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率 |
| C.通过关闭或开启活塞1可以控制反应的进行 |
| D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
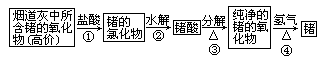
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.③④ | D.只有① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
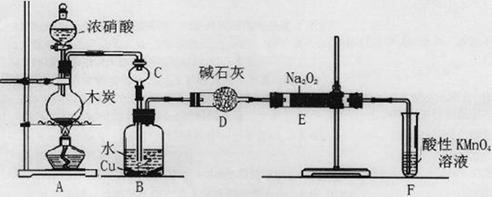
| A.自来水 | B.碘化钾淀粉试液 | C.淀粉 | D.白糖 E.食醋 F.白酒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
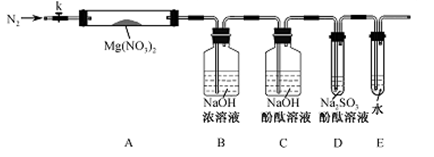
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
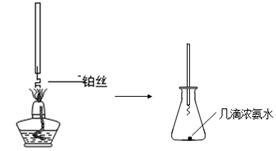
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 | | |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
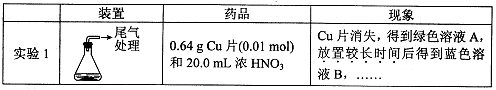
 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 , CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ

 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com