
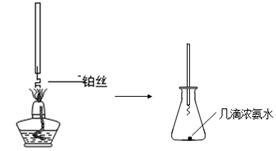
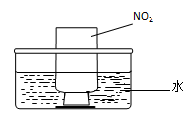
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 | | |
| | | |
 Fe(OH)3 + 3H+ (2分)
Fe(OH)3 + 3H+ (2分)| 影响条件 | 实验操作 | 预期现象和结论 |
| ②盐的浓度 | 用量筒取10mL Fe(NO3)3于烧杯中,用pH计测出pH值.另取90mL蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值。 | 前后测得pH值之差小于1。说明加水稀释后平衡右移,生成更多的H+,故增大Fe(NO3)3浓度,抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 用pH计分别测定0.05mol?L-1Fe(NO3)3和0.5mol?L-1Fe(NO3)3的pH,并比较大小。 | 二种溶液的pH值之差小于1。说明增大c(Fe(NO3)3),抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol?L-1Fe(NO3)3于试管中加入少量NaHCO3固体。 | 溶液颜色变深。说明加入少量NaHCO3固体可减少c(H+)促进Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol?L-1Fe(NO3)3于试管中加入几滴1.0mol?L-1NaOH | 产生红棕色沉淀,棕黄色溶液变成无色,说明加入NaOH可减少c(H+)能促进Fe(NO3)3水解。 |
| ③升高温度 | 取少量0.5mol?L-1Fe(NO3)3于试管中,再用酒精灯加热一段时间,观察溶液颜色 | 加热后溶液颜色变深。说明升高温度促进Fe(NO3)3水解。 |
| 或③降低温度 | 取少量0.5mol?L-1Fe(NO3)3于试管中,再将试管置于放有冰水混合物的烧杯中一段时间,观察溶液颜色 | 棕黄色溶液颜色变浅。说明降低温度能抑制Fe(NO3)3水解。 |
 Fe(OH)3 + 3H+
Fe(OH)3 + 3H+ | 影响条件 | 实验操作 | 预期现象和结论 |
| ②盐的浓度 | 用量筒取10mL Fe(NO3)3于烧杯中,用pH计测出pH值.另取90mL蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值。 | 前后测得pH值之差小于1。说明加水稀释后平衡右移,生成更多的H+,故增大Fe(NO3)3浓度,抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 用pH计分别测定0.05mol?L-1Fe(NO3)3和0.5mol?L-1Fe(NO3)3的pH,并比较大小。 | 二种溶液的pH值之差小于1。说明增大c(Fe(NO3)3),抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol?L-1Fe(NO3)3于试管中加入少量NaHCO3固体。 | 溶液颜色变深。说明加入少量NaHCO3固体可减少c(H+)促进Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol?L-1Fe(NO3)3于试管中加入几滴1.0mol?L-1NaOH | 产生红棕色沉淀,棕黄色溶液变成无色,说明加入NaOH可减少c(H+)能促进Fe(NO3)3水解。 |
| ③升高温度 | 取少量0.5mol?L-1Fe(NO3)3于试管中,再用酒精灯加热一段时间,观察溶液颜色 | 加热后溶液颜色变深。说明升高温度促进Fe(NO3)3水解。 |
| 或③降低温度 | 取少量0.5mol?L-1Fe(NO3)3于试管中,再将试管置于放有冰水混合物的烧杯中一段时间,观察溶液颜色 | 棕黄色溶液颜色变浅。说明降低温度能抑制Fe(NO3)3水解。 |


科目:高中化学 来源:不详 题型:单选题








| A.是两种单质组成的混合物 | B.相对分子质量为2400 |
| C.是一种化合物 | D.其晶体类型属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.PH3分子中有未成键的孤对电子 | B.PH3是非极性分子 |
| C.PH3是一种强氧化剂 | D.PH3分子的P-H键是非极性键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
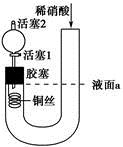
| A.关闭活塞1,加入稀硝酸至液面a处 |
| B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率 |
| C.通过关闭或开启活塞1可以控制反应的进行 |
| D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
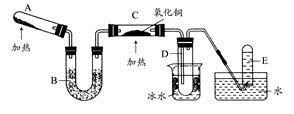
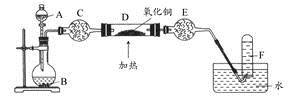
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
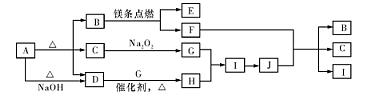
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.氯化铵与KNH2反应:NH4Cl+KNH2 KCl+2NH3↑ KCl+2NH3↑ |
| B.二价活泼金属M(下同)与液氨反应:M+2NH3=M(NH2)2+H2 |
| C.盐酸与MNH反应:2HCl+MNH=MCl2+NH3↑ |
| D.氯化铵与MO反应:2NH4Cl+MO=M(NH2)2+2HCl+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
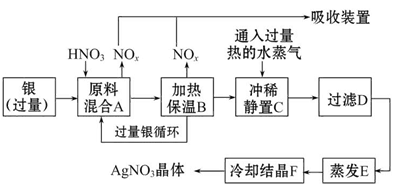
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com