
����Ŀ��ij���жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5(ֱ��С�ڵ���2.5��m������������)������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1��PM2.5��ɢ�ڿ������γɵķ�ɢϵ__(����������������������)���塣
��2����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
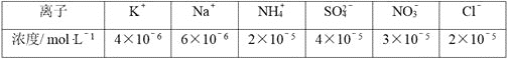
���ݱ��������жϴ�������Ϊ__(����������������)�ԣ���ʾ����������Ե�c(H��)��c(OH��)=__mol��L-1��
��3��úȼ���ŷŵ���������SO2��NOx���γ����꣬��Ⱦ����������NaClO2��Һ�ڼ��������¿ɶ�������������������Ч���dz��á�������ж������������̵����ӷ���ʽ��
__ClO2-��__NO��__=__Cl-��__NO3-��__
��4��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ�д����̿��ˮ������Ӧ�Ļ�ѧ����ʽ��__��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ�����__(����ĸ)��
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
��5������β����NOx��CO�����ɼ�ת����
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��д������������NO�Ļ�ѧ����ʽ��__��
������ȼ�Ͳ���ȫȼ��ʱ����CO��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ���仯ѧ��Ӧ����ʽΪ__��
���𰸡������� �� 10-4 3 4 4OH- 3 4 2H2O C��H2O(g)![]() CO��H2 ab N2+O2
CO��H2 ab N2+O2![]() 2NO 2CO+2NO
2NO 2CO+2NO![]() 2CO2+N2
2CO2+N2
��������
��1������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��
��2���۲�����з������к���![]() ��
��![]() ˮ�������ԣ�PM2.5��Ϊ���ԣ�
ˮ�������ԣ�PM2.5��Ϊ���ԣ�
��3����Ӧ��NԪ�ػ��ϼ���+2�۵�NO����Ϊ![]() ��+5�ۣ�������3�ۣ�ClԪ����
��+5�ۣ�������3�ۣ�ClԪ����![]() ��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����
��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����![]() ϵ��Ϊ3����NOϵ��Ϊ4�����õ���غ㼰Ԫ���غ���ƽ���ʵ�ϵ����
ϵ��Ϊ3����NOϵ��Ϊ4�����õ���غ㼰Ԫ���غ���ƽ���ʵ�ϵ����
��4����̼��ˮ������Ӧ����һ����̼���������ڶ�������Ϊ������������ն���������Լ��Ͷ�����������Ӧ��
��5�������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ������������NO�ǿ����е����������ŵ�����һ����������������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ��һ����̼��һ�����������������ɵ����Ͷ�����̼��
��1������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��PM2.5��ָ������ֱ���ӽ���2.5��106m�Ŀ����ֱ������100nm����ϸ�������ɢ�ڿ������γɵķ�ɢϵ���ǽ��壬
�ʴ�Ϊ�������ڣ�
��2���۲�����з���![]() ˮ�������ԣ�PM2.5�������Ϊ���ԣ�������pHֵ������Һ�е���غ����õ���
ˮ�������ԣ�PM2.5�������Ϊ���ԣ�������pHֵ������Һ�е���غ����õ���![]() ����������ֵ��������ʽ�ӿɵ�c(H+)=1.0��104mol/L��������Ũ��Ϊ104mol/L��
����������ֵ��������ʽ�ӿɵ�c(H+)=1.0��104mol/L��������Ũ��Ϊ104mol/L��
�ʴ�Ϊ���104��
��3����Ӧ��NԪ�ػ��ϼ���+2�۵�NO����Ϊ![]() ��+5�ۣ�������3�ۣ�ClԪ����
��+5�ۣ�������3�ۣ�ClԪ����![]() ��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����
��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����![]() ϵ��Ϊ3����NOϵ��Ϊ4������ݵ���غ㡢Ԫ���غ㼰��Ӧ�ڼ��������½��У�����ƽ�õķ���ʽΪ��
ϵ��Ϊ3����NOϵ��Ϊ4������ݵ���غ㡢Ԫ���غ㼰��Ӧ�ڼ��������½��У�����ƽ�õķ���ʽΪ��![]() ��
��
�ʴ�Ϊ��3��4��4OH��3��4��2H2O��
��4���ٽ�̿��ˮ������Ӧ����ˮú���Ļ�ѧ����ʽΪ��C��H2O(g)![]() CO��H2��
CO��H2��
�ʴ�Ϊ��C��H2O(g)![]() CO��H2��
CO��H2��
��a������������������������Ծ��������������ͨ�ԣ��ܹ���Ӧ��SO2+Ca(OH)2=CaSO3��+H2O����a��ȷ��
b����������ˮ��Һ�������ᣬ����Ҳ�ܹ���̼���Ʒ�Ӧ��SO2+Na2CO3=Na2SO3+CO2�������Կ�����̼������Һ��ϴ�Ӽ�����b��ȷ��
c�������������Ȼ�����Һ����Ӧ����c����
d��SO2��������������Һ�е��ܽ�Ⱥ�С�����Բ�����������������Һ��ϴ��Һ����d����
�ʴ�Ϊ��ab��
��5���٣�����������NO�ǿ����е����������ŵ�����һ����������Ӧ�Ļ�ѧ����ʽΪ��N2+O2![]() 2NO��
2NO��
�ʴ�Ϊ��N2+O2![]() 2NO��
2NO��
�ڣ�������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ��һ����̼��һ�����������������ɵ����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��
�ʴ�Ϊ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�H2 (g)��CO2 (g) ![]() CO(g)��H2O(g)��ƽ�ⳣ��K��9/4�����¶����ڼס��ҡ���������ͬ�ĺ����ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�����±���ʾ�������жϲ���ȷ����
CO(g)��H2O(g)��ƽ�ⳣ��K��9/4�����¶����ڼס��ҡ���������ͬ�ĺ����ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�����±���ʾ�������жϲ���ȷ����
��ʼŨ�� | �� | �� | �� |
c(H2)/ mol��L-1 | 0.010 | 0.020 | 0.020 |
c(CO2)/ mol��L-1 | 0.010 | 0.010 | 0.020 |
A.ƽ��ʱ������CO2��ת���ʴ���60%
B.ƽ��ʱ���ͱ���H2��ת���ʾ���60��
C.��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
D.ƽ��ʱ������c(CO��)�Ǽ��е�2������0.012 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������ɣ��ж�������䣬������ȷ������ǣ� ��
�ټ�������ʵ��۵���ԭ�����������������
����(![]() )�ǵڢ�
)�ǵڢ�![]() �壬���⻯����ȶ���С��
�壬���⻯����ȶ���С��![]()
�۸���ͬ����Ԫ�صĵ�һ�����ܱ仯���ƣ��Ƴ�Al�ĵ�һ�����ܱ�Mg��
�ܵڶ����ڷǽ���Ԫ�ص���̬�⻯������ˮ��ˮ��Һ��Ϊ����
����(![]() )����ͬ���壬�䵥�ʼ��������ᷴӦ������������������Һ��Ӧ
)����ͬ���壬�䵥�ʼ��������ᷴӦ������������������Һ��Ӧ
����X+��Y2���ĺ�����Ӳ�ṹ��ͬ����ԭ��������X>Y
A.�٢ۢ�B.�٢ڢ�C.�ۢܢ�D.�ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ�ֻҰ�ɫ���壬����ˮ������Ӧ������NH3��Al��800�����Ϸ�Ӧ���Ʊ�AlN��ʵ��װ�����£�

�ش��������⣺
(1)װ�â���ʢ�ŵ�ҩƷΪ__________��װ�âܵ����������հ�����__________��
(2)ʵ��ʱ�ȵ�ȼ�ٴ��ƾ��ƣ���Ŀ����______________________________________��
(3)Ϊʹʵ�鰲ȫ��װ�âܵ�β������������_____________________��
(4)װ�â��з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��װ�â��з�����Ӧ�Ļ�ѧ����ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��.FeCl3����ѧʵ���ҳ��õ��Լ������������Ʊ������������塣
�����Ʊ�������������IJ���������ȷ����____________������ĸ����
A�����Ȼ�����Һ�еμ���������������ϡ��Һ
B����������Ȼ���������Һ
C���ڰ�ˮ�еμ��Ȼ���Ũ��Һ
D���ڷ�ˮ�еμӱ����Ȼ�����Һ�������Һ��ʺ��ɫ��
��2��д��Ba(OH)2��Һ������NaHCO3��Һ��Ӧ�����ӷ���ʽ:___________________��
��3��д��������ĵ���ʽ��________________��д�����������д��ڵ����л�ѧ�����ͣ�____________________��
��4�������к������ۣ��ɼ�______��ȥ���ʣ������Ļ�ѧ����ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)������ͼװ�ã�����NH3�����������MxOy��Ӧ����M��N2��H2O��ͨ����������ˮ���������ⶨM�����ԭ��������a���Լ���Ũ��ˮ��

������a������Ϊ_________������b��װ����Լ�������___________��
�ڰ�����������ȷ��װ������˳��Ϊ_________(����ĸ��װ�ÿ��ظ�ʹ��)��
(2)����������һ�ֹ�ҵ�Σ���������������Ӧ�ù㷺��������ͼ��ʾװ��(�г�װ����ʡ��)��ҩƷ��̽���������������ᷴӦ���������ɷ֡�

��֪����.NO+NO2+2OH-=2NO2-+H2O
��.����Һ�����¶ȣ�NO2(21��)��NO(-152��)
�ٷ�ӦǰӦ���ɼУ���ͨ��һ��ʱ�䵪����Ŀ����________________��
��Ϊ�˼���װ��A�����ɵ�����������������˳��(������������)��A��_________����װ���������������еIJ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
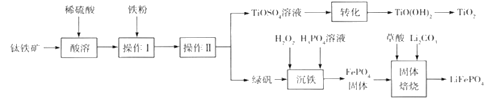
����Ŀ���Ѱ�(TiO2)����Ҫ�İ�ɫ������LiFePO4������ӵ�ص��������ϡ�һ������������( ��Ҫ�ɷ�ΪFeTiO3 ������Fe2O3 )�����Ѱۺ�LiFePO4 ������������������ͼ��ʾ:
�ش���������:
��1�� LiFePO4��Fe�Ļ��ϼ���_______________________��
��2����������������ǰ��Ҫ���з����������Ŀ����__________________________________��
��3�������ӷ���ʽ��ʾ����I�������۵�Ŀ��:__________________________������IIΪһϵ�в����������Ǽ���Ũ������ȴ�ᾧ�������������õ����մ�������������___________��
��4��TiO2+��ˮ��������ˮ������ӷ���ʽΪ______________________����ת�������õ���TiO2+��ˮ���������Ҫ����Һ���ȣ����ȵ�Ŀ����________________________________��
��5�����������ĵ���ʹFe3+����FePO4������Һ��c(PO43-)= 1.0��10-17mol/Lʱ����ΪFe3+ ������ȫ������Һ��Fe3+������ȫʱ��c(Fe3+)=_______mol/L[��֪:���¶�����Ksp(FePO4)=1.0��10-22]��
��6���������������Ʊ�LiFePO4�Ĺ����У�����17% H2O2��Һ�����( H2C2O4)����������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4)��һ�����͡���Ч�����ˮ���������Ҳ�����ɶ�����Ⱦ����������:K2FeO4Ϊ��ɫ���壬����KOH��Һ������ǿ�����ԣ������Ի�������Һ�п��ٲ���O2,�ڼ�����Һ�н��ȶ�����Cl2��KOH��Һ��20 �����·�Ӧ����KClO,�ڽϸ��¶��������� KC1O3��
(1)��K2FeO4����������ˮ�ȿ��������ֿ��Գ�������ԭ����K2FeO4��ˮ��Ӧ����Fe(OH)3 ���壬д���÷�Ӧ�����ӷ���ʽ:____________________________��
(2)ʵ���ҳ����������Ʊ�NaClO����NaOH��Fe(NO3)3��Ӧ�Ʊ�K2FeO4���ݷ�Ӧԭ��������������������������װ����������ʵ��װ�ã����õ�װ�õĽӿ�����˳��___________________________��
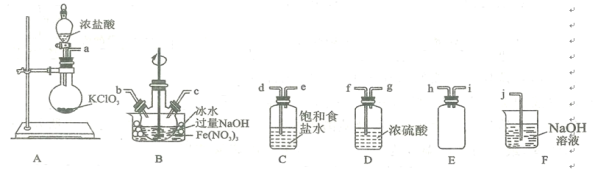
(3)д��װ��A�з��������ӷ���ʽ: ______________________ ��
(4)������ƿ�ñ�ˮԡ��ԭ���� _________________��A��ʢ��KC1O3���������� ___________��
(5)��ʵ��õ���Na2FeO4�ټ��뱥��KOH��Һ�У��������Ϻ�ɫ��K2FeO4�־��壬��ԭ����________________________________________________________��
(6)������ش��ȼ�⣺��ȡ3.0 g�Ʊ���K2FeO4�־�����������KOH��Һ�У�����������KCrO2��ַ�Ӧ����ʱCrԪ��ȫ����CrO42- ��ʽ���ڣ�,���ˣ���Һ��100 mL����ƿ�ж��ݡ�ȡ10.00 mL����ϡ�����ữ������ 0.10 mol/L�ģ�NH4)2Fe(SO4)2����Һ�ζ����յ㣨��ʱCrԪ��ȫ����Cr3+��ʽ���ڣ����ظ��ζ�3�Σ�ƽ�����ģ�NH4)2Fe(SO4)2��Һ�����Ϊ24.00 mL�����K2FeO4��Ʒ�Ĵ���Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��8��12�Žӽ���ҹʱ�֣�����������һ����װ����ͷ������ը��������ը���Ǽ�װ���ڵ���ȼ�ױ���Ʒ����ը������죬��������Ģ���ơ��������յ���Ϣ������װ������Σ�ջ�ѧƷ�����мء��ơ������ơ�����ء��ռ��軯�ơ�������ϩ���ȵ���ȡ��˵�����Σ�ջ�ѧƷ�����л����������������ᡢ����李��軯�ơ�4��6-��������-���ٶ������ӵȡ�
�ش��������⣺
��1�������NH4NO3��NaCN�������ʵ�Ԫ���е�һ������������__________����Ԫ�ط��ţ�������ԭ��_____________________________________________
��2����������ͼ����У���ˮ���ܽ�Ƚϴ���� �������ƣ���ԭ����_______���ռ������ľ�������Ϊ______���Na2S����S2-�Ļ�̬�����Ų�ʽ��____________��
��3�����������NO3-�����幹��Ϊ ������ԭ�ӵ��ӻ��������Ϊ__________
��4��1mol������NaCN��CN-�����Ħм���Ϊ______����CN-��Ϊ�ȵ�����ķ����� ����CN��2�ֳ�Ϊ��±�أ�ʵ���ҿ������軯�ơ��������̺�Ũ�����ڼ����������Ƶã�д�ɸ��Ʊ��Ļ�ѧ����ʽ___________��
��5���ƼغϽ����ڽ������壬��ij�ֺϽ�ľ����ṹ��ͼ��ʾ���Ͻ�Ļ�ѧʽΪ____________��������K ԭ�ӵ���λ��Ϊ ����֪����ԭ�Ӱ뾶r��Na��=186pm��r��K��=227pm�����㾧��Ŀռ������� ________���г�����ʽ������Ҫ������������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com