
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
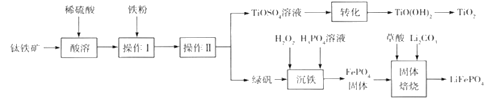
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
【答案】 +2 增加钛铁矿与硫酸按触面积,增大酸溶速率 2H++Fe==H2↑+Fe2+、Fe+2Fe3+==3Fe2+ 蒸发皿 TiO2++2H2O![]() TiO(OH)2+2H+ 促进水解( 或加快水解反应速率) 1.0×10-5 20:9
TiO(OH)2+2H+ 促进水解( 或加快水解反应速率) 1.0×10-5 20:9
【解析】钛铁矿[主要成分为钛酸亚铁(FeTiO)3,含有少量Fe2O3]加硫酸溶解生成TiO2+和Fe3+、Fe2+,加入铁还原铁离子:2Fe3++Fe=3Fe2+,得到硫酸亚铁和TiOSO4,对溶液蒸发浓缩、冷却结晶,过滤得到绿矾晶体和TiOSO4溶液,将TiOSO4溶液加热,促进TiO2+的水解生成TiO(OH)2,TiO2++2H2O=TiO(OH)2+2H+,分解得到钛白粉(TiO2);将绿矾与过氧化氢、H3PO4混合沉铁:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,将得到的FePO4与草酸、Li2CO3焙烧生成锂离子电池的正极材料LiFePO4。
(1)LiFePO4中Li的化合价为+1价,P为+5价O为-2价,根据正负化合价的代数和为0,Fe的化合价是+2,故答案为:+2;
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎可以增加钛铁矿与硫酸按触面积,增大酸溶速率,故答案为:增加钛铁矿与硫酸按触面积,增大酸溶速率;
(3)加入铁粉主要是还原铁离子,也会与过量的酸反应:2H++Fe==H2↑+Fe2+、2Fe3++Fe=3Fe2+;操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器为蒸发皿,故答案为:2H++Fe==H2↑+Fe2+、Fe+2Fe3+==3Fe2+;蒸发皿;
(4)TiO2+易水解生成TiO(OH)2,其水解的离子方程式为TiO2++2H2O![]() TiO(OH)2+2H+;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热可以促进水解,故答案为:TiO2++2H2O
TiO(OH)2+2H+;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热可以促进水解,故答案为:TiO2++2H2O![]() TiO(OH)2+2H+;促进水解;
TiO(OH)2+2H+;促进水解;
(5)Ksp(FePO4)= c(Fe3+) c(PO43-),则c(Fe3+)=![]() =
=![]() =1.0×10-5 mol/L,故答案为:1.0×10-5;
=1.0×10-5 mol/L,故答案为:1.0×10-5;
(6)“沉铁”的为绿矾与过氧化氢、H3PO4混合生成FePO4,离子方程式为:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,焙烧时的反应方程式为2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑;H2O2与草酸(H2C2O4)的物质的量之比为1:1,则17% H2O2溶液与草酸(H2C2O4)的质量比为
2LiFePO4+H2O+3CO2↑;H2O2与草酸(H2C2O4)的物质的量之比为1:1,则17% H2O2溶液与草酸(H2C2O4)的质量比为![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.ClO2 是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO2:2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是 __________;被还原元素的元素符号是 _________ ;
(2)试比较 KClO3 和 CO2 的氧化性强弱 ____________________________________;
(3)消毒时,ClO2 还可以将水中的 Fe2+ 、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,此过程说明 ClO2 具有 ___________ ( 填“氧化”或“还原” ) 性;
(4)当转移 0.2mol 电子时,生成的ClO2在标准状况下的体积为 ___________________。
Ⅱ.根据已学知识回答下列问题:
(1)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
(3)配平下面两个反应:
① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
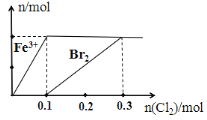
A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
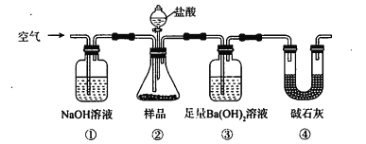
下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
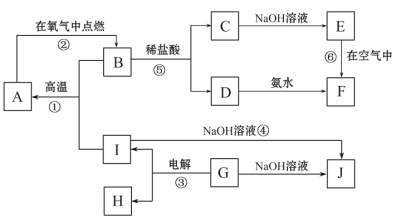
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
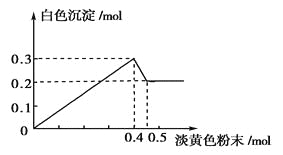
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如图所示。
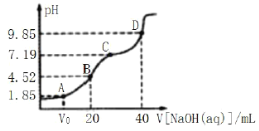
下列说法不正确的是
A. 点A所得溶液中:Vo>10mL
B. 点B所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. 点C所得溶液中:c(Na+)>3c(HSO3-)
D. 点D所得溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.H2SO4(稀)![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
B.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.Al![]() NaAlO2
NaAlO2![]() AlCl3溶液
AlCl3溶液![]() 无水AlCl3
无水AlCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com