
【题目】Ⅰ.ClO2 是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO2:2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是 __________;被还原元素的元素符号是 _________ ;
(2)试比较 KClO3 和 CO2 的氧化性强弱 ____________________________________;
(3)消毒时,ClO2 还可以将水中的 Fe2+ 、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,此过程说明 ClO2 具有 ___________ ( 填“氧化”或“还原” ) 性;
(4)当转移 0.2mol 电子时,生成的ClO2在标准状况下的体积为 ___________________。
Ⅱ.根据已学知识回答下列问题:
(1)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
(3)配平下面两个反应:
① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:______________________________________。
【答案】H2C2O4 Cl KClO3 > CO2 氧化 4.48L 1:5 2:3 2 1 1 1 2 2 16 2 2 5 8 2KMnO4 +5SO2 + 2H2O = K2SO4 + 2MnSO4 +2 H2SO4
【解析】
Ⅰ(1)2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,分析化合价,KClO3中氯化合价降低,H2C2O4中碳化合价升高,因此还原剂的化学式是H2C2O4;被还原元素的元素符号是Cl,故答案为:H2C2O4;Cl。
(2)根据氧化剂的氧化性大于氧化产物的氧化性,可得KClO3和CO2的氧化性强弱是KClO3 > CO2,故答案为:KClO3 > CO2。
(3)消毒时,Fe2+、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,化合价升高,则ClO2化合价降低,说明ClO2具有氧化性,故答案为:氧化。
(4)KClO3中氯化合价由+5价变为+4价,2mol KClO3转移2mol电子生成2molClO2,当转移0.2mol电子时,生成0.2molClO2,在标准状况下的体积为0.2mol×22.4L/mol = 4.48L,故答案为:4.48L。
Ⅱ(1)在反应KIO3 + 6HI=3I2 + KI + 3H2O中,KIO3化合价降低,作氧化剂,HI化合价升高,作还原剂,但只有5molKI升高,因此氧化剂与还原剂的物质的量之比为1:5,故答案为:1:5。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中FeS中硫化合价升高变为单质硫,发生氧化反应,物质的量为2mol,H2SO4中硫化合价降低,有3mol硫降低,发生还原反应,因此发生氧化反应和发生还原反应的硫元素物质的量之比为2:3,故答案为:2:3。
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中FeS中硫化合价升高变为单质硫,发生氧化反应,物质的量为2mol,H2SO4中硫化合价降低,有3mol硫降低,发生还原反应,因此发生氧化反应和发生还原反应的硫元素物质的量之比为2:3,故答案为:2:3。
(3) ①氯气化合价降低2,二氧化硫化合价升高2,因此根据得失电子守恒和质量守恒得到:2H2O +1Cl2 +1SO2 ==1H2SO4 +2HCl,故答案为:2;1;1;1;2。
②高锰酸钾降低5,生成氯气升高2,根据得失电子守恒和质量守恒得到:
2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2↑ + 8H2O,故答案为:2;16;2;2;5;8。
根据以上两个反应反应,高锰酸钾表现强的氧化性,二氧化硫表现强的还原性,因此高锰酸钾和二氧化硫发生氧化还原反应,2KMnO4 +5SO2 + 2H2O = K2SO4 + 2MnSO4+2H2SO4,故答案为:2KMnO4 +5SO2 + 2H2O = K2SO4 + 2MnSO4 +2 H2SO4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
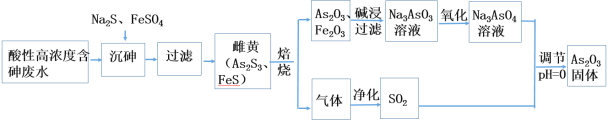
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
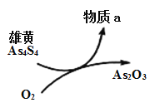
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
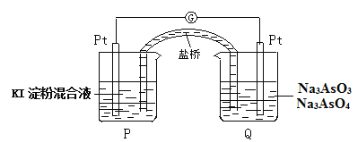
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
请回答下列问题:
(1)列出CH3COONa的水解平衡常数Kh的计算式:_________。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___<___< ____(用编号填写)。
(3)写出向NaClO溶液中通入少量CO2的化学方程式________。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:_____________。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH___0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“=”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列五组物质:A、 O2和O3 B 、![]() Cl和
Cl和![]() Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与
Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与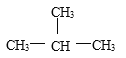 E、
E、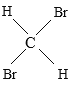 与
与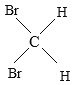
(1)______组两种物质互为同位素;
(2)______组两种物质互为同素异形体;
(3)______组两种物质互为同系物;
(4)______组两种物质互为同分异构体;
(5)______组两种物质实为同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列几种物质:①盐酸 ②石墨 ③酒精 ④SO2 ⑤熔融KHSO4 ⑥Ba(OH)2固体 ⑦氨水⑧硝酸
(1)属于强电解质的有_____________;属于非电解质的有_____________。(填序号)
(2)⑧和铜在一定条件下可发生如下反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,酸性介质与氧化剂的物质的量之比为________;请用双线桥法分析电子转移方向和数目_______。
Ⅱ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________________________________________________ 。
(2)下列三种情况下,离子方程式与(1)相同的是______(填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的______曲线表示(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不属于化合、分解、置换、复分解等四种基本反应类型的是( )
A.CuSO4+H2S=CuS↓ + H2SO4
B.2FeCl3+Cu=2FeCl2+CuCl2
C.Cu2(OH)2CO3 ![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.甲与乙的相对分子质量之比等于x:y
B.等质量的甲与乙的分子个数之比等于x:y
C.同温同压下甲与乙的密度之比等于x:y
D.同温同体积下等质量的甲与乙的压强之比等于y:x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
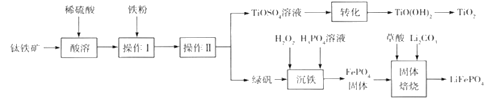
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐X由三种元素组成,其具有良好的热电性能,在热电转换领域具有广阔的应用前景。为研究它的组成和性质,现取12.30g化合物X进行如下实验:

试根据以上内容回答下列问题:
(1)X的化学式为_____________。
(2)无色溶液B中通入过量CO2产生白色沉淀的离子方程式为______________。
(3)蓝色溶液F中通入中SO2气体会产生白色沉淀,该沉淀中氯元素质量分数为35.7%,其离子方程式为____________。
(4)白色沉淀C煅烧的固体产物与D高温反应可生成化合物X,其化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com