
【题目】盐X由三种元素组成,其具有良好的热电性能,在热电转换领域具有广阔的应用前景。为研究它的组成和性质,现取12.30g化合物X进行如下实验:

试根据以上内容回答下列问题:
(1)X的化学式为_____________。
(2)无色溶液B中通入过量CO2产生白色沉淀的离子方程式为______________。
(3)蓝色溶液F中通入中SO2气体会产生白色沉淀,该沉淀中氯元素质量分数为35.7%,其离子方程式为____________。
(4)白色沉淀C煅烧的固体产物与D高温反应可生成化合物X,其化学方程式为__________。
【答案】CuAlO2 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+ 2Al2O3+4CuO![]() 4CuAlO2+O2↑
4CuAlO2+O2↑
【解析】
蓝色溶液A与过量的NaOH溶液反应得到蓝色沉淀B与无色溶液B,则溶液A含有Cu2+、沉淀B为Cu(OH)2,沉淀B加热分解生成黑色固体D为CuO,D与盐酸反应得到蓝色溶液F为CuCl2;无色溶液B通入过量的二氧化碳得到白色沉淀C,故溶液B中含有AlO2-、白色沉淀C为Al(OH)3、E为AlCl3;则溶液A中含有Al3+,由元素守恒可知固体X中含有Cu、Al元素,则红色固体A为Cu,结合转化可知X中还含有O元素。结合题意中物质的质量计算解答。
(1) 根据上述分析,固体X中含有Cu、Al和O元素。Al(OH)3的物质的量为![]() =0.1mol,Cu(OH)2的物质的量为
=0.1mol,Cu(OH)2的物质的量为![]() =0.05mol,Cu单质的物质的量为
=0.05mol,Cu单质的物质的量为![]() =0.05mol,由原子守恒可知12.3gX中含有0.1mol Al原子、0.1mol Cu原子,则含有O原子为:
=0.05mol,由原子守恒可知12.3gX中含有0.1mol Al原子、0.1mol Cu原子,则含有O原子为:![]() =0.2mol,则X中Cu、Al、O原子数目之比为0.1mol∶0.1mol∶0.2mol=1∶1∶2,故X的化学式为CuAlO2,故答案为:CuAlO2;
=0.2mol,则X中Cu、Al、O原子数目之比为0.1mol∶0.1mol∶0.2mol=1∶1∶2,故X的化学式为CuAlO2,故答案为:CuAlO2;
(2) B中含有AlO2-,B中通入过量CO2产生白色沉淀的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3) F为CuCl2,F溶液中通入中SO2气体会产生白色沉淀,该沉淀中氯元素质量分数为35.7%,Cu、Cl原子的个数之比为![]() =1:1,则沉淀为CuCl,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+;
=1:1,则沉淀为CuCl,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+;
(4)Al(OH)3煅烧的固体产物为Al2O3,与CuO高温反应可生成化合物CuAlO2,其化学方程式为:2Al2O3+4CuO ![]() 4CuAlO2+O2↑,故答案为:2Al2O3+4CuO
4CuAlO2+O2↑,故答案为:2Al2O3+4CuO ![]() 4CuAlO2+O2↑。
4CuAlO2+O2↑。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.ClO2 是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO2:2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是 __________;被还原元素的元素符号是 _________ ;
(2)试比较 KClO3 和 CO2 的氧化性强弱 ____________________________________;
(3)消毒时,ClO2 还可以将水中的 Fe2+ 、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,此过程说明 ClO2 具有 ___________ ( 填“氧化”或“还原” ) 性;
(4)当转移 0.2mol 电子时,生成的ClO2在标准状况下的体积为 ___________________。
Ⅱ.根据已学知识回答下列问题:
(1)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
(3)配平下面两个反应:
① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
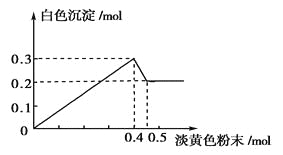
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如图所示。
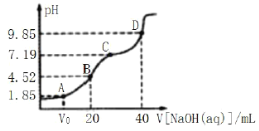
下列说法不正确的是
A. 点A所得溶液中:Vo>10mL
B. 点B所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. 点C所得溶液中:c(Na+)>3c(HSO3-)
D. 点D所得溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应或离子反应方程式正确的是( )
A.苯与溴水反应:![]() +Br2
+Br2![]() +HBr
+HBr
B.1一氯丙烷中加入氢氧化钠的水溶液并加热:CH3CH2CH2Cl+NaOH![]() CH3CH=CH2↑+NaCl+H2O
CH3CH=CH2↑+NaCl+H2O
C.苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
D.实验室制取乙炔的反应:CaC2+2H2O→Ca(OH)2+CH≡CH↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
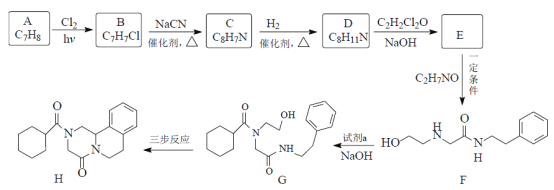
已知:i ![]() ii
ii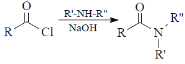
(1)下列说法正确的是______________。
A.1molC最多消耗2molH2 B.可以用双缩脲鉴别H与F
C.化合物E、F均可发生消去反应 D.化合物H的分子式为C19H24N2O2
(2)试剂a的结构简式______________,E→F的反应类型为______________。
(3)D→E的化学方程式是__________________________________________。
(4)写出同时符合下列条件的C的所有同分异构体的结构简式______________。
①分子中有苯环而且是苯环的邻位二取代物;
②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N)。
(5)G→H三步反应依次为氧化、加成、取代反应,则G→H的合成路线为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
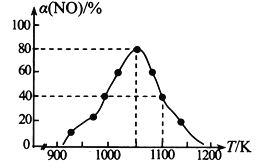
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
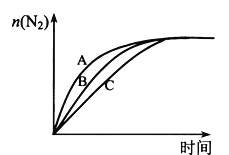
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.H2SO4(稀)![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
B.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.Al![]() NaAlO2
NaAlO2![]() AlCl3溶液
AlCl3溶液![]() 无水AlCl3
无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com