
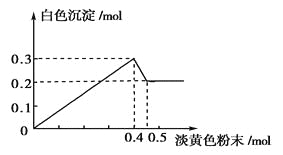
【题目】有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
【答案】过氧化钠 NH4+、Mg2+、Al3+ Cu2+、Fe3+ n(Mg2+):n(Al3+):n(NH4+)=2:1:1 2Na2O2+2H2O=4NaOH+O2↑ ![]() Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
【解析】
有一透明溶液,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀,则淡黄色固体为Na2O2,图象中加入0.4mol Na2O2后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知Mg(OH)2为0.2mol,Al(OH)3为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol Na2O2之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时NH4+完全反应,所以产生气体0.3mol,即为Na2O2与H2O反应生成的O2和NH4+生成的NH3。
(1)由上述分析可知,淡黄色固体为:Na2O2,名称为过氧化钠;
(2)由上述分析可知,溶液中肯定有离子NH4+、Al3+、Mg2+,肯定没有Fe3+和Cu2+离子;
(3)根据纵坐标:n(Mg2+)=n[Mg(OH)2]=0.2mol,n(Al3+)=0.3mol-n[Mg(OH)2]=0.1mol,当n(Na2O2)=0.4mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=0.4mol×1/2=0.2mol,所以n(NH4+)=n(NH3)=0.3mol-n(O2)=0.1mol,n(Mg2+):n(Al3+):n(NH4+)=0.2mol:0.1mol:0.1mol=2:1:1;
(4)①由上述分析可知,淡黄色固体为:Na2O2,与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
②刺激性气味的气体即氨气产生为铵根与氢氧根离子在加热条件下反应生成,离子方程式为:![]() ;
;
③沉淀部分减少即为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
请回答下列问题:
(1)列出CH3COONa的水解平衡常数Kh的计算式:_________。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___<___< ____(用编号填写)。
(3)写出向NaClO溶液中通入少量CO2的化学方程式________。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:_____________。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH___0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“=”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.甲与乙的相对分子质量之比等于x:y
B.等质量的甲与乙的分子个数之比等于x:y
C.同温同压下甲与乙的密度之比等于x:y
D.同温同体积下等质量的甲与乙的压强之比等于y:x
查看答案和解析>>
科目:高中化学 来源: 题型:
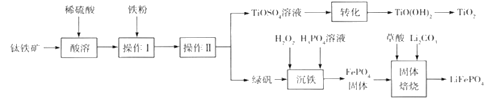
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为 “氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 发生的反应为2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用胆矾(CuSO4·5H2O)配制1L0.1mol·L1 CuSO4溶液,正确的做法是( )
A.将胆矾加热除去结晶水后,称取16g溶于适量水中,然后将此溶液稀释至1L
B.将25g胆矾溶于少量水中,然后将此溶液稀释至1L
C.称取胆矾25g溶于1L水中
D.将16g胆矾溶于少量水中,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。下列说法不正确的是
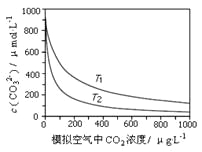
A. T1>T2
B. 海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,导致CO32-浓度降低
C. 当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低
D. 大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐X由三种元素组成,其具有良好的热电性能,在热电转换领域具有广阔的应用前景。为研究它的组成和性质,现取12.30g化合物X进行如下实验:

试根据以上内容回答下列问题:
(1)X的化学式为_____________。
(2)无色溶液B中通入过量CO2产生白色沉淀的离子方程式为______________。
(3)蓝色溶液F中通入中SO2气体会产生白色沉淀,该沉淀中氯元素质量分数为35.7%,其离子方程式为____________。
(4)白色沉淀C煅烧的固体产物与D高温反应可生成化合物X,其化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正在研制的一种“高容量、低成本”锂——铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
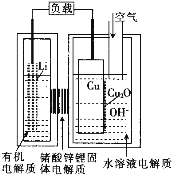
A.通空气时,铜被腐蚀,表面产生CuO
B.放电一段时间后右侧水溶液电解质中LiOH浓度逐渐增大
C.放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
D.整个反应过程中,铜相当于催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com