
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
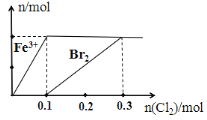
A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
【答案】C
【解析】
由图可知,向200 mL FeBr2溶液中通入0.1mol氯气时,Fe2+恰好被完全氧化为Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,由方程式可得n(Fe2+)为0.2mol,则n(Br-)为0.4mol;通入氯气0.3mol时,溶液中0.4mol Br-恰好被完全氧化为Br2,反应的离子方程式为2Br-+ Cl2=Br2 + 2Cl-,则氯气与溴化亚铁溶液完全反应的离子方程式为2Fe2++4Br- + 3Cl2=2Fe3++2Br2 +6Cl-。
A项、由题给图示可知,向200 mL FeBr2溶液中通入氯气,亚铁离子先反应,说明还原性Fe2+> Br-,还原剂的还原性越强,对应氧化产物的氧化性越弱,则氧化性强弱:Br2 > Fe3+,故A正确;
B项、由通入0.1mol氯气时,Fe2+恰好被完全氧化为Fe3+可得,溶液中n(Fe2+)为0.2mol,则FeBr2溶液的浓度为![]() =1mol/L,故B正确;
=1mol/L,故B正确;
C项、当通入n(Cl2)为0. 12 mol时,0.2mol Fe2+已经完全被氧化为Fe3+,n(Fe3+)为0.2mol,过量的0. 02 mol Cl2与0. 04 mol Br-反应,溶液中n(Br-)为(0.4—0.04)mol=0.36mol,则溶液中的离子浓度有c (Fe 3+)∶c( Br-)= 0.2mol∶0.36mol=5:9,故C错误;
D项、n(FeBr2)∶n(Cl2)=1∶1时,溶液中Fe2+已经完全被氧化为Fe3+,有一半Br-被氧化为Br2,反应的离子方程式为2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】以乙炔为原料通过以下流程能合成有机物中间体D。

已知:(1)
(2):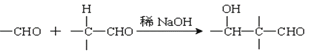
请回答下列问题:
(1)化合物A的分子式为___________,1mol A完全燃烧需要消耗_____mol氧气。
(2)反应②的反应类型是:______________;化合物B的名称是:____________。
(3)写出①反应的化学方程式_________________________________________________。
(4)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE。写出E的结构简式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。
(1)下列装置中能够实现化学能转化为电能的是______(填字母)。
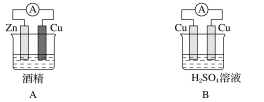

(2)写出该装置正极反应的电极反应式_________。
(3)该装置中溶液里的阴离子移向______________(填电极的化学式)极。
(4)若装置中转移了0.2mol电子,则理论上溶液增加的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应: 。我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如图所示:
。我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如图所示:
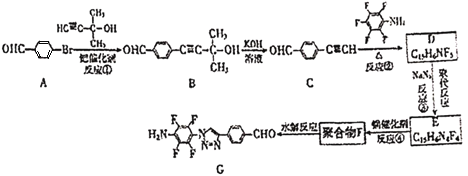
已知:
(1)化合物A的官能团是____。
(2)反应①的反应类型是____。
(3)关于B和C,下列说法正确的是____(填字母序号)。
a.利用质谱法可以鉴别B和C
b.B可以发生氧化、取代、消去反应
c.可用酸性高锰酸钾溶液检验C中含有碳碳三键
(4)B生成C的过程中还有另一种生成物X,分子式为![]() ,核磁共振氢谱显示只有一组峰,X的结构简式为____。
,核磁共振氢谱显示只有一组峰,X的结构简式为____。
(5)反应②的化学方程式为____。
(6)E的结构简式为____。
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如图,写出H、I、J的结构简式:____。
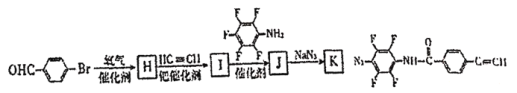
(8)聚合物F的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是

A. 如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C. 金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s金刚石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同温同压下,H2(g)+C12(g)==2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;
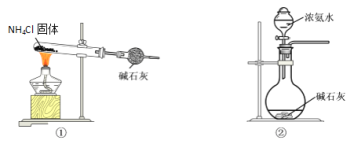
(1)部分实验装置如图所示。制取氨气的装置应选用________(选填编号)。
(2)写出实验中获得碳酸氢钠的离子方程式____________
(3)灼烧碳酸氢钠需要_________(选填编号)。
a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯
(4)选择的实验方案是________(选填“Ⅰ”或“Ⅱ”),说明选择的理由_____________
(5)甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论。乙同学认为甲的结论不一定正确,你认为乙同学的理由是____。
(6)按下列流程处理母液(提取完碳酸氢钠后的滤液)可得到NH4Cl。
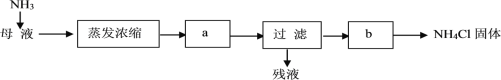
通入NH3的作用是_______(选填编号)。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素单质及其化合物有着广泛应用。
![]() 在
在![]() 密闭容器中放入
密闭容器中放入![]()
![]() ,一定温度进行如下反应
,一定温度进行如下反应![]()
反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 的数据见下表:
的数据见下表:
时间 温度 | 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -- | -- | -- |
|
|
回答下列问题:
![]() 的电子式为______。
的电子式为______。
![]() 温度下,反应平衡常数
温度下,反应平衡常数![]() ______。
______。
![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,
,![]() 的平衡转化率
的平衡转化率![]() ______
______![]() 。
。
![]() 在一定条件下发生如下分解:
在一定条件下发生如下分解:![]() 在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______![]() 填字母序号
填字母序号。
a.n(N2O)=n(NO2) b.容器内压强保持不变 c.υ正(N2O)=υ正(NO2) d.气体颜色保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05molB.1molC.1.05molD.0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com