
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;
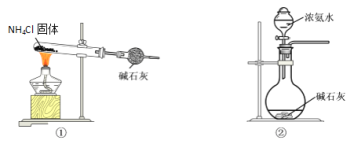
(1)部分实验装置如图所示。制取氨气的装置应选用________(选填编号)。
(2)写出实验中获得碳酸氢钠的离子方程式____________
(3)灼烧碳酸氢钠需要_________(选填编号)。
a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯
(4)选择的实验方案是________(选填“Ⅰ”或“Ⅱ”),说明选择的理由_____________
(5)甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论。乙同学认为甲的结论不一定正确,你认为乙同学的理由是____。
(6)按下列流程处理母液(提取完碳酸氢钠后的滤液)可得到NH4Cl。
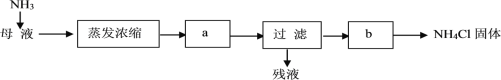
通入NH3的作用是_______(选填编号)。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl纯度
【答案】② CO2+H2O+NH3+Na+→NaHCO3↓+NH4+ b、e Ⅱ 因二氧化碳气体溶解度较小,若先通入二氧化碳气体再通入氨气后,生成的碳酸氢钠量较少,难以析出沉淀 稀硝酸可能不足,没有把碳酸钠完全反应掉 bc
【解析】
(1)实验室制备氨气的方法是利用氯化铵和氢氧化钙加热反应生成或利用浓氨水滴入固体氢氧化钠或氧化钙或碱石灰中生成氨气;
(2)氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体和氯化铵;
(3)灼烧固体在坩埚中进行;
(4)氨气极易溶于水,二氧化碳能溶于水,所以应先通入氨气,从而保证了通入二氧化碳时,二氧化碳被充分反应;
(5)碳酸钠和硝酸银反应也能生成碳酸银白色沉淀;
(6)通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作得到晶体。
(1)装置①加热分解氯化铵生成氨气和氯化氢在试管口处重新生成氯化铵,不能制得大量氨气,②装置浓氨水滴入碱石灰固体溶解过程中放热,一水合氨分解生成氨气,可以制备氨气,故答案为②;
(2)氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体和氯化铵,反应的离子方程式:CO2+H2O+NH3+Na+=NaHCO3↓+NH4+;
(3)灼烧碳酸氢钠需要在坩埚中加热灼烧,选择be,故答案为:b、e;
(4)将足量NH3通入饱和NaCl溶液中,再在所得溶液中通入足量CO2,氨气极易溶于水,二氧化碳能溶于水,所以应先通入氨气,从而保证了通入二氧化碳时,二氧化碳被充分反应,因二氧化碳气体溶解度较小,若先通入二氧化碳气体再通入氨气后,生成的碳酸氢钠量较少,难以析出沉淀;
(5)甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论,乙同学认为甲的结论不一定正确,理由是:稀硝酸可能不足,没有把碳酸钠完全反应掉;
(6)根据NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵,通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度所故bc正确,故答案为:bc。


科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。

下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
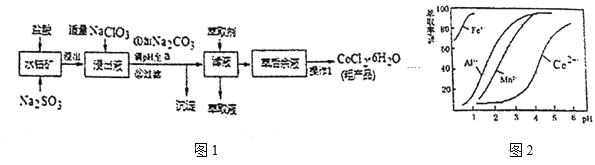
【题目】![]() 是一种饲料营养强化剂。一种利用水钴矿(主要成分为
是一种饲料营养强化剂。一种利用水钴矿(主要成分为![]() 、
、![]() ,还含少量
,还含少量![]() 、
、![]() 、MnO等),制取
、MnO等),制取![]() 的工艺流程如图1:
的工艺流程如图1:
已知:①浸出液含有的阳离子主要有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等;
等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③![]() 熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
沉淀物 |
|
|
|
|
|
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中![]() 发生反应的离子方程式____。
发生反应的离子方程式____。
(2)写出NaClO3发生反应的主要离子方程式____,若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(3)“加![]() 调pH至a”,过滤所得到的沉淀成分为___。
调pH至a”,过滤所得到的沉淀成分为___。
(4)制得的![]() 在烘干时需减压烘干的源因是___。
在烘干时需减压烘干的源因是___。
(5)萃取剂对金属高子的萃取率与pH的关系如图2。向“滤液”中加入萃取剂的目的是___﹔其使用的最佳pH范围是___。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 17g H2O2中含有非极性键的数目为NA
B. 常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 13. 8g NO2与足量水反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
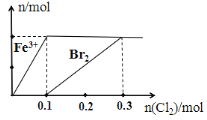
A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质,回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 ______ 。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 ______
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 ______ 。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/L FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置, CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 ______(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有 ______(填离子符号),反应的离子方程式为 ______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ______ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是 ______ ,生成沉淀的原因是 ______(用平衡移动原理解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.Na2S2O3溶液与稀H2SO4反应:S2O32-+6H+=2S↓+3H2O
B.在海带灰的浸出液中滴加H2O2得到I2:2I+H2O2+2H+=I2+O2↑+2H2O
C.向 NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①Ar ②Na2O2 ③AlCl3 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是___,不存在化学键的是_____,离子化合物有_______
(2)由离子键和极性键构成的物质是__________
(3)N2的电子式为_____ HClO的电子式为________NH4Cl的电子式为___________
(4)用电子式表示MgF2的形成过程___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com