
【题目】![]() 是一种饲料营养强化剂。一种利用水钴矿(主要成分为
是一种饲料营养强化剂。一种利用水钴矿(主要成分为![]() 、
、![]() ,还含少量
,还含少量![]() 、
、![]() 、MnO等),制取
、MnO等),制取![]() 的工艺流程如图1:
的工艺流程如图1:
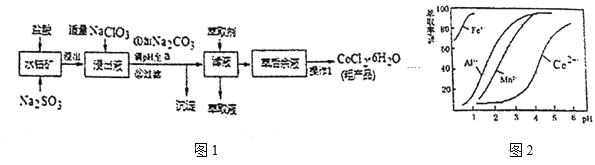
已知:①浸出液含有的阳离子主要有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等;
等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③![]() 熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
沉淀物 |
|
|
|
|
|
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中![]() 发生反应的离子方程式____。
发生反应的离子方程式____。
(2)写出NaClO3发生反应的主要离子方程式____,若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(3)“加![]() 调pH至a”,过滤所得到的沉淀成分为___。
调pH至a”,过滤所得到的沉淀成分为___。
(4)制得的![]() 在烘干时需减压烘干的源因是___。
在烘干时需减压烘干的源因是___。
(5)萃取剂对金属高子的萃取率与pH的关系如图2。向“滤液”中加入萃取剂的目的是___﹔其使用的最佳pH范围是___。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
【答案】![]()
![]()
![]()
![]() 、
、![]() 降低烘干温度,防止产品分解 除去溶液中的
降低烘干温度,防止产品分解 除去溶液中的![]() B
B
【解析】
含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl26H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干。
(1)向水钴矿主要成分为![]() 、
、![]() ,还含少量
,还含少量![]() 、
、![]() 、MnO等,加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有
、MnO等,加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,所以
等,所以![]() 和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为:
和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为: ![]() ,
,
(2)![]() 的作用是将
的作用是将![]() 氧化成
氧化成![]() ,其反应的离子方程式为:
,其反应的离子方程式为:![]() ;在酸性条件下,
;在酸性条件下, ![]() 与氯离子发生氧化还原反应生成氯气,其反应的离子方程式为:
与氯离子发生氧化还原反应生成氯气,其反应的离子方程式为:![]() ↑
↑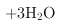 ;
;
(3) ![]() 的作用是将
的作用是将![]() 氧化成
氧化成![]() ,加
,加![]() 调pH至a,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:
调pH至a,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:![]() ↓
↓![]() ↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:
↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:![]() ↓
↓![]() ↑,所以沉淀成分为:
↑,所以沉淀成分为:![]() 、
、![]() ,
,
(4)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤,
(5)根据流程图可以知道,此时溶液中存在![]() 、
、![]() 金属离子; 由萃取剂对金属离子的萃取率与pH的关系可以知道,调节溶液pH在3.0~3.5之间,可使
金属离子; 由萃取剂对金属离子的萃取率与pH的关系可以知道,调节溶液pH在3.0~3.5之间,可使![]() 完全沉淀,并防止
完全沉淀,并防止![]() 转化为
转化为![]() 沉淀。
沉淀。


科目:高中化学 来源: 题型:
【题目】某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一;As是生成物之一。
(1)①写出未配平的该反应的化学方程式:_________________________
②在该反应中,得电子的物质是__________,被氧化的元素是____________。
③在反应中,每转移1 mol电子,消耗HCl________mol。
④下列叙述中不正确的是_____________________(填写字母序号)。
a.在相同条件下,第ⅦA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。该反应的离子方程式为_________________________,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。该反应的化学方程式为____________________。
②把KI换成KBr,则CCl4层变为_______________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是氮元素的一种氧化物。下图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列有关反应和NO性质的说法中,正确的是
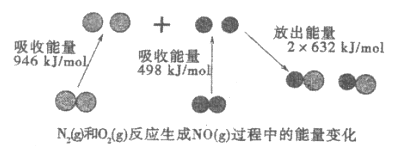
A.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B.1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ
C.在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2,则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min)
D.N2(g)分子中化学键键能大于O2(g)分子中化学键键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、海水是可以综合利用的。从海水中提取食盐和溴的过程:

(1)请写出一种海水淡化的方法________________________。
(2)步骤Ⅰ获取Br2的离子方程式为_________________________________________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是________(填化学式)。
Ⅱ、海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。证明海带中含有碘的实验步骤:
①用剪刀剪碎海带,用酒精湿润,放入坩埚中。
②灼烧海带至完全成灰,停止加热,冷却。
③将海带灰加蒸馏水溶解,搅拌、煮沸、过滤。
④在滤液中滴加稀硫酸及过氧化氢,然后加入几滴淀粉溶液,(涉及反应的离子方程式为2I-+H2O2+2H+=I2+2H2O)。
能证明海带中含有碘的实验步骤是________(填序号),现象是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。
(1)下列装置中能够实现化学能转化为电能的是______(填字母)。
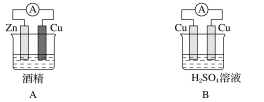

(2)写出该装置正极反应的电极反应式_________。
(3)该装置中溶液里的阴离子移向______________(填电极的化学式)极。
(4)若装置中转移了0.2mol电子,则理论上溶液增加的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)能说明该反应已达到平衡状态的是_______
A.υ(A)=2υ(B) B.容器内气体密度不变
C.v逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_______,V6=_______。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应: 。我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如图所示:
。我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如图所示:
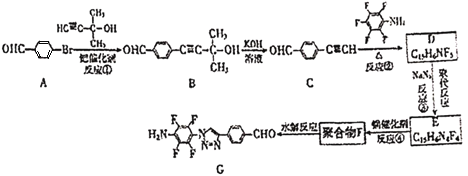
已知:
(1)化合物A的官能团是____。
(2)反应①的反应类型是____。
(3)关于B和C,下列说法正确的是____(填字母序号)。
a.利用质谱法可以鉴别B和C
b.B可以发生氧化、取代、消去反应
c.可用酸性高锰酸钾溶液检验C中含有碳碳三键
(4)B生成C的过程中还有另一种生成物X,分子式为![]() ,核磁共振氢谱显示只有一组峰,X的结构简式为____。
,核磁共振氢谱显示只有一组峰,X的结构简式为____。
(5)反应②的化学方程式为____。
(6)E的结构简式为____。
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如图,写出H、I、J的结构简式:____。
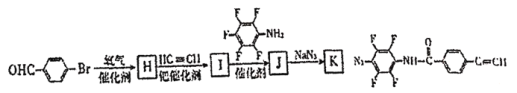
(8)聚合物F的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;
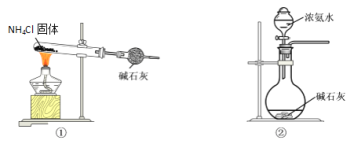
(1)部分实验装置如图所示。制取氨气的装置应选用________(选填编号)。
(2)写出实验中获得碳酸氢钠的离子方程式____________
(3)灼烧碳酸氢钠需要_________(选填编号)。
a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯
(4)选择的实验方案是________(选填“Ⅰ”或“Ⅱ”),说明选择的理由_____________
(5)甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论。乙同学认为甲的结论不一定正确,你认为乙同学的理由是____。
(6)按下列流程处理母液(提取完碳酸氢钠后的滤液)可得到NH4Cl。
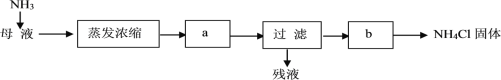
通入NH3的作用是_______(选填编号)。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
Ⅰ.脱硝:
(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+133 kJ/mol
H2O(g)=H2O(l) ΔH2=-44 kJ/mol
H2的燃烧热ΔH3=-285.8 kJ/mol
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为__________。
(2)用NH3催化还原法消除氮氧化物,发生反应:
4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0
相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示。
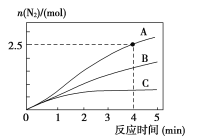
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=____。
②下列说法正确的是____。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH_____(填“增大”“减小”或“不变”),负极的电极反应式为________。
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染。常温下,将a mol/L醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=________(用含a、b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com