
����Ŀ��ij��Ӧ�����Ϊ5L�ĺ����ܱյľ��������н��У������ʵ�����ʱ��ı仯�������ͼ��ʾ����֪A��B��C��Ϊ���壩��

��1���÷�Ӧ�Ļ�ѧ����ʽΪ_______��
��2����Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����Ϊ_______��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����_______
A���ԣ�A����2�ԣ�B�� B�������������ܶȲ���
C��v�棨A����������C�� D������ֵ����ʵ������
E. ��������ƽ����Է����������ٸı��״̬
��4����ͼ���ƽ��ʱ����ת����Ϊ_______��
��5��Ϊ���о�����ͭ�����������������ʵ�Ӱ�죬ijͬѧ���������һϵ�е�ʵ�飺�����������Ļ����Һ�ֱ���뵽6��ʢ�й���Zn���������У��ռ����������壬��¼�����ͬ�������������ʱ�䡣
ʵ�� �����Һ | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
����CuSO4��Һ(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
������ɴ�ʵ����ƣ����У�V1=_______��V6=_______��
�ڸ�ͬѧ���ó��Ľ���Ϊ������������CuSO4��Һʱ���������������ʻ�����ߣ����������CuSO4��Һ����һ����ʱ���������������ʷ������½���������������������½�����Ҫԭ��_______��
���𰸡�2A + B ![]() 2C0.1mol.(L��min) ��1C��E40%3010������һ����CuSO4�������ɵĵ���Cu������Zn������������Zn��H2SO4��Һ�ĽӴ����
2C0.1mol.(L��min) ��1C��E40%3010������һ����CuSO4�������ɵĵ���Cu������Zn������������Zn��H2SO4��Һ�ĽӴ����
��������
(1)��ͼ����Կ�����A��B�����ʵ�����С����A��BΪ��Ӧ�C�����ʵ��������࣬����CΪ���������Ӧ����2minʱ����n(A)=2mol����n(B)=1mol����n(C)=2mol����ѧ��Ӧ�У������ʵ����ʵ����ı仯ֵ�뻯ѧ�����������ȣ����n(A)����n(B)����n(C)=2��1��2�����Է�Ӧ�Ļ�ѧ����ʽΪ��2A+B![]() 2C��(2)��ͼ����Կ�������Ӧ��ʼ��2����ʱ����n(B)=1mol��B��ƽ����Ӧ����Ϊ��
2C��(2)��ͼ����Կ�������Ӧ��ʼ��2����ʱ����n(B)=1mol��B��ƽ����Ӧ����Ϊ��![]() =0.1mol/(Lmin)��(3)A��v(A)=2v(B)����˵������Ӧ���淴Ӧ�Ĺ�ϵ�������жϷ�Ӧ�Ƿ�ﵽƽ�⣬��A����B����������������������䣬������䣬���������ܶ�ʼ�ղ��䣬���ж��Ƿ�ﵽƽ��״̬����B����C���ڸ÷�Ӧ��A��C�ļ�������ȣ���v��(A)=v��(C)ʱ�����淴Ӧ������ȣ�˵����Ӧ�Ѵ�ƽ��״̬�ˣ���C��ȷ��D�������ڸ����ʵ����ʵ�����ȣ�����˵������ֵ�Ũ�Ȳ��ٱ仯�����ж��Ƿ�ﵽƽ��״̬����D����E��������������ʼ�ղ��䣬����������ʵ�����ȷ��������������ƽ����Է����������ٸı䣬��˵����ʱ��ƽ��״̬����E��ȷ����ΪCE��(4)ƽ��ʱA��ת����Ϊ
=0.1mol/(Lmin)��(3)A��v(A)=2v(B)����˵������Ӧ���淴Ӧ�Ĺ�ϵ�������жϷ�Ӧ�Ƿ�ﵽƽ�⣬��A����B����������������������䣬������䣬���������ܶ�ʼ�ղ��䣬���ж��Ƿ�ﵽƽ��״̬����B����C���ڸ÷�Ӧ��A��C�ļ�������ȣ���v��(A)=v��(C)ʱ�����淴Ӧ������ȣ�˵����Ӧ�Ѵ�ƽ��״̬�ˣ���C��ȷ��D�������ڸ����ʵ����ʵ�����ȣ�����˵������ֵ�Ũ�Ȳ��ٱ仯�����ж��Ƿ�ﵽƽ��״̬����D����E��������������ʼ�ղ��䣬����������ʵ�����ȷ��������������ƽ����Է����������ٸı䣬��˵����ʱ��ƽ��״̬����E��ȷ����ΪCE��(4)ƽ��ʱA��ת����Ϊ![]() ��100%=40%��(5)��Ҫ�Ա�����Ч������ô���˷�Ӧ�����ʵ�����һ�����⣬Ҫ��֤����������ͬ��������̽������ͭ����Ӱ�죬��ôÿ���������Ҫ������ͬ�����鷴Ӧ�������ҲӦ����ͬ��A��������Ϊ30ml����ô������������Ҳ��Ϊ30ml��������ͭ��Һ��ˮ������Ӧ��ͬ��F��������ͭ20ml��ˮΪ0����ô����Ϊ20ml������V6=10ml��V1=30ml������Ϊп����������ͭ��Ӧ��ֱ������ͭ��Ӧ��������ᷴӦ��������������ͭ���϶�ʱ����Ӧʱ��ϳ����������ɵ�ͭ�ḽ����пƬ�ϣ����谭пƬ�����������Ӧ���������������½���
��100%=40%��(5)��Ҫ�Ա�����Ч������ô���˷�Ӧ�����ʵ�����һ�����⣬Ҫ��֤����������ͬ��������̽������ͭ����Ӱ�죬��ôÿ���������Ҫ������ͬ�����鷴Ӧ�������ҲӦ����ͬ��A��������Ϊ30ml����ô������������Ҳ��Ϊ30ml��������ͭ��Һ��ˮ������Ӧ��ͬ��F��������ͭ20ml��ˮΪ0����ô����Ϊ20ml������V6=10ml��V1=30ml������Ϊп����������ͭ��Ӧ��ֱ������ͭ��Ӧ��������ᷴӦ��������������ͭ���϶�ʱ����Ӧʱ��ϳ����������ɵ�ͭ�ḽ����пƬ�ϣ����谭пƬ�����������Ӧ���������������½���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������л��������빦�ܹ�ϵͼ���й������������

A. С������ϸ���У�����A�������ǣ�����E�ǵ���
B. ��ͬ������E��F���������ֽ⣬�ͷ������϶����F
C. ����C������Լ��20�֣��������Ԫ����C��H��O��N
D. SARS����������H����ˮ�������CO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ����������巢�����з�Ӧ�� aM��g���� bN��g��![]() cW(g)����һƽ����M�����Ũ��Ϊ0.5mol/L�����ں����£����ܱ��������������1�����ٴ�ƽ��ʱ�����M�����Ũ��Ϊ0.3mol��L��������������ȷ����
cW(g)����һƽ����M�����Ũ��Ϊ0.5mol/L�����ں����£����ܱ��������������1�����ٴ�ƽ��ʱ�����M�����Ũ��Ϊ0.3mol��L��������������ȷ����
A. ��Ӧ�������� B. ƽ�������ƶ�
C. N��ת������� D. W�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X�Ľṹ��ʽ����ͼ��ʾ�����й����л���X��˵����ȷ����

A. X��ѧʽΪC8H6O6
B. X�ɷ����ӳɷ�Ӧ��ˮ�ⷴӦ��������Ӧ
C. X���������е�ԭ��һ����ͬһƽ����
D. X��ʹ��ˮ��KMnO4��Һ��ɫ��ԭ����������̼̼˫���й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ԫ���� H2Y ��Һ�еμ� KOH ��Һ�����û����Һ�� pH ������Ũ�ȱ仯�Ĺ�ϵ����ͼ��ʾ�������й�˵����������

A. ���� M ��ʾ pH�� lg![]() �ı仯��ϵ
�ı仯��ϵ
B. a����Һ�У�c(H+) �D c(OH-)��2c(Y2��)��c(HY-) �D c(K+)
C. H2Y �ĵڶ������볣��Ka2(H2Y)��10��4.3
D. ����b����Һ�У�c(H2Y)��c(Y2-)��c(HY-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W�����ڱ���λ����ͼ������Wԭ�ӵĴ��������������ڲ�������������������ĵ�����֮�͡�����˵������ȷ����
![]()
A. ����⻯��ķе㣺X��W
B. Ԫ�صķǽ����ԣ�Z��W��Y
C. �����ӵİ뾶��С��Y��W��Z
D. �������Ӧˮ��������ԣ�Y��W��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���

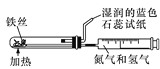
�� �� �� ��
A. ��װ�ü����к��ȵIJⶨ
B. ��װ������ȡCO2����
C. ��װ�ñ�����CH3COONa��Һ��CH3COONa����
D. ��װ�ö�ģ�ҵ�ư������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��̼�����׳ƴ������Ϊ��ʹ�õ�ԭ����__________________�������ӷ���ʽ��ʾ����
��2��25��ʱ��pH��Ϊ11�� NaOH ��Һ��Na2CO3��Һ����ˮ�����OH-Ũ��֮����_____
��3����0.1 mol��L��1��Na2CO3��Һ�У���������Ũ�ȹ�ϵʽ��ȷ����________��
A��[CO32��]��[HCO3��]��0.1 mol��L��1
B��[CO32��]��[HCO3��]��[H2CO3]��0.1 mol��L��1
C��[OH��]��[H��]��[HCO3��]
D��[Na��]��[OH��]��[H��]��[HCO3��]
��4��������0.1 mol��L��1��Na2CO3��Һ�У�����Ũ���ɴ�С��˳����__________________________________��
��5������BaSO4�������Һ�еμ�Na2CO3��Һ������BaCO3��������ʱ��Һ��![]() =__________������֪Ksp(BaCO3)=2.6��109��Ksp(BaSO4)=1.1��1010���������һλС����
=__________������֪Ksp(BaCO3)=2.6��109��Ksp(BaSO4)=1.1��1010���������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ�ƿ��ǩ�ϵ����ݣ�
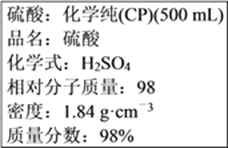
���㣺
��1������������ʵ���Ũ����________mol��L��1��
��2��ij��ѧ��ȤС������������ʵ�ʵ��̽��ʱ����Ҫ90 mL 4.6 mol��L��1��ϡ���ᣬ������ϡ����ʱ��Ҫȡ________mL�ĸ��������ʱ��ѡ�õ�������Ҫ����Ͳ���ձ�����������_______��_______���ں�������д��ȱ���������ƣ�����������ϡ������Һʱ���ݵIJ���Ϊ ___________ ��
��3�����������������ˮ��Ϻ�������Һ�����ʵ����ʵ���Ũ��________9.2 mol��L��1��(����ڻ���ڻ�С��)
��4�����ƹ����У����в�����ʹ���Ƶ�ϡ������ҺŨ��ƫ�ߵ��� ______������ţ���
����ȡŨ�������Ͳ������ˮϴ��2��3�Σ�����ϴ��Һת������ƿ
������ƿʹ��ʱδ����
���ܽ��δ����ȴ����Һ������
�ܶ���ʱ��С������������ˮ�ε�ƿ��
������Ͳ��ȡŨ����ʱ���Ӷ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com