
| A.100℃时,pH=12的NaOH(aq)和pH=2的H2SO4(aq)恰好中和,所得溶液的pH=7 |
| B.25℃时,pH=12的氨水和pH=2的H2SO4(aq)等体积混合,所得溶液的pH>7 |
| C.100℃时,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合,所得溶液的pH=7 |
| D.25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和,所得溶液的pH="7" |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:不详 题型:填空题
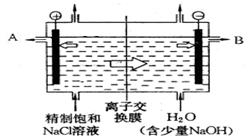
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A>B | B.A=10-6 B |
| C.B=10-6 A | D.A=B |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“E85”是由两种物质组成的一种燃料,属新能源 |
| B.推广使用乙醇汽油是为了减少温室气体排放 |
| C.等质量的“E85”和汽油充分燃烧后放出的能量相等 |
| D.乙醇属可再生性能源 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质都是离子化合物,而弱电解质都是共价化合物 |
| B.中和PH值相等、体积相等的盐酸和醋酸,盐酸所消耗的氢氧化钠少 |
| C.将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减小到原来的1/2 |
| D.常温下,PH为12的溶液一定是碱溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com