
| A、0.44s | B、1s |
| C、1.33s | D、2s |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1制取并收集少量的CO2 |
| B、用图2装置,检查该装置的气密性 |
| C、用100mL量筒量取20.0 mL稀硫酸 |
| D、用洁净的玻璃棒蘸取待测液,在火焰上灼烧,发现火焰为黄色,说明待测液中含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
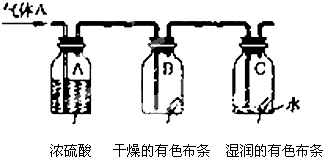
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,不符合
,不符合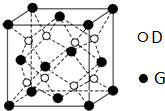
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com