

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 1mol该有机物完全燃烧可以产生6mol水 |
分析 A.该有机物结构不对称,含8种位置的H原子;
B.该有机物中不含苯环;
C.Et代表-CH2CH3;
D.该物质分子式为C9H12O4,根据H原子守恒计算生成水的物质的量.
解答 解:A.该有机物结构不对称,含8种位置的H原子,所以核磁共振波谱图中有8种峰,故A正确;
B.该有机物中不含苯环,则不属于芳香族化合物,故B错误;
C.由结构及球棍模型可知,Et代表-CH2CH3,故C正确;
D.该物质分子式为C9H12O4,根据H原子守恒知,1mol该有机物含有12molH原子,完全燃烧可以产生6mol水,故D正确;
故选B.
点评 本题考查有机物的结构和性质,侧重于有机物知识的综合应用,为高考常见题型,难度不大,注意把握有机物的结构特点和官能团的性质,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 过滤时,可用玻璃棒搅拌漏斗中的液体以加快过滤速率 | |
| B. | 用湿润的pH试纸测溶液的pH,因溶液被稀释而使测量值变大 | |
| C. | 酸碱滴定管、容量瓶、分液漏斗使用前必须检查是否漏水 | |
| D. | 酸碱滴定实验中,需用待滴定溶液润洗锥形瓶以减小实验误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)-1.9KJ可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S(s)+O2(g)═SO2(g)+297.23 kJ,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| D. | 在稀水溶液中 H+(aq)+OH-(aq)═H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的溶液混合时,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
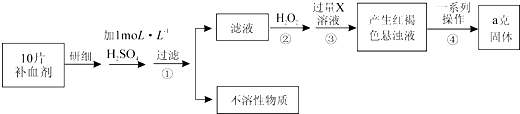
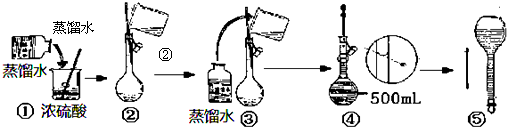
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素.
如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素. ;
; +Br2→
+Br2→ +3HBr;
+3HBr; +NaOH→
+NaOH→ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/L | B. | 0.1mol/L | C. | 0.2mol/L | D. | 0.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-=Fe2+ | |
| B. | 根据盖斯定律,可计算某些难以直接测定的反应焓变 | |
| C. | 增大压强不能降低活化能,但能增加活化分子百分数 | |
| D. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CO2,溶液pH减小 | |
| B. | 加入少量NH4Cl固体,平衡向正反应方向移动 | |
| C. | 慢慢升高温度,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$逐渐减小 | |
| D. | 加入NaOH 固体后冷却到室温,溶液的KW=c(OH-)•c(H+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01 mol•L-1,c(H+)•c(OH-)不变 | |
| D. | 溶液中存在:c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c( A2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com