
【题目】工业上常用甲烷与水蒸气的催化重整反应制取水煤气。T℃时,每生成5.6gCO该反应吸热40.6kJ。
(1)该反应的热化学方程式为_____;
(2)该反应的逆反应速率方程为v逆=k逆·cm (CO)·cn (H2), k逆、m、n需要通过实验测定。T℃时,测得有关数据为:
序号 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | v逆/mol·L﹣1·min-1 |
Ⅰ | 0.05 | 0.02 | 4.80×10-3 |
Ⅱ | 0.03 | 0.05 | 4.50×10-2 |
Ⅲ | 0.02 | 0.02 | 1.92×10-3 |
Ⅳ | 0.03 | 0.01 | 3.60×10-4 |
通过计算,k逆的数值为___,当c(CO)=0.01mol/L、c(H2)=0.03mol/L时,v逆=___________;
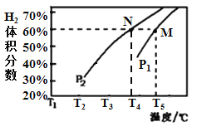
(3)在体积为3 L的密闭容器中,加入甲烷和水蒸气各3 mol,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度、压强的关系如图所示,则压强P1___P2(“>”、“=”或“<”);温度为T4℃、压强为P1 MPa时,N点表示的体系状态v正_____v逆(填“>”、“=”或“<”);若P1 =5.0×103 MPa,M点表示的体系状态CH4的平衡转化率为_______、压强平衡常数KP=___________。
【答案】CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH = +203.0 kJ/mol 12000 3.24×10-3 mol/(L·min) > < 66.7% 1.08×108 MPa2
CO(g)+3H2(g) ΔH = +203.0 kJ/mol 12000 3.24×10-3 mol/(L·min) > < 66.7% 1.08×108 MPa2
【解析】
(1). 每生成5.6gCO该反应吸热40.6kJ,则生成28gCO则吸热40.6kJ×![]() =203 kJ/mol,则热化学方程式为 CH4(g)+H2O(g)
=203 kJ/mol,则热化学方程式为 CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH = +203.0 kJ/mol,
CO(g)+3H2(g) ΔH = +203.0 kJ/mol,
故答案为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH = +203.0 kJ/mol
CO(g)+3H2(g) ΔH = +203.0 kJ/mol
(2)根据速率方程 v逆=k逆cm (CO)·cn (H2),代入Ⅰ,Ⅲ两组数据,可得到4.80×10-3= k逆0.05m0.02n (1) ,1.92×10-3 = k逆0.02 m0.02n (2);![]() 得到0.4=0.4m,则m=1;
得到0.4=0.4m,则m=1;
代入Ⅱ,Ⅳ两组数据,可得到4.50×10-2= k逆0.03m0.05n (3),3.60×10-4 = k逆0.03m0.01n (4),![]() 得到125=5n,则n=3;
得到125=5n,则n=3;
v逆=k逆·cm (CO)·cn (H2),代入Ⅰ组数据,4.80×10-3= k逆0.05m0.02n ,m=1,n=3,则k逆= =12000;当c(CO)=0.01mol/L、c(H2)=0.03mol/L时,v逆=k逆·cm (CO)·cn (H2)= 12000×0.01×(0.03)3=3.24×10-3 mol/(L·min)
=12000;当c(CO)=0.01mol/L、c(H2)=0.03mol/L时,v逆=k逆·cm (CO)·cn (H2)= 12000×0.01×(0.03)3=3.24×10-3 mol/(L·min)
故答案为:12000,3.24×10-3 mol/(L·min)
(3)主反应为:CH3OH(g)+H2O(g)CO2(g)+3H2(g),nH2O:nCH3OH=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,CH3OH(g)+H2O(g)CO2(g)+3H2(g) 反应为气体分子数增多的反应,随着反应的进行,体系压强增大,增大压强不利于反应正向进行,所以压强p1大于p2,N点时反应尚未达到平衡,反应仍需正向进行,所以v正大于v逆,M点时平衡体系中H2的体积分数为60%,相同条件下的体积分数就是物质的量分数
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始(mol) 3 3 0 0
转化(mol) x x x 3x
平衡(mol) 3x 3x x 3x
所以有![]() ,可得x=2,所以平衡时c(CH4)的平衡转化率=
,可得x=2,所以平衡时c(CH4)的平衡转化率=![]() =66.7%;根据反应CH4(g)+H2O(g)=CO(g)+3H2(g),n(H2O):n(CH4)=1:1的原料气充入恒容密闭容器中,CH4(g)+H2O(g)=CO(g)+3H2(g),P1 =5.0×103 MPa的恒压条件下,各物质平衡时的物质的量分别是CH4 1mol,H2O1mol,CO2mol,H26mol,混合气体的总物质的量为1+1+2+6=10mol,压强平衡常数Kp,气体组分的分压=总压强×(气体组分的物质的量/气体总物质的量),根据公式KP=
=66.7%;根据反应CH4(g)+H2O(g)=CO(g)+3H2(g),n(H2O):n(CH4)=1:1的原料气充入恒容密闭容器中,CH4(g)+H2O(g)=CO(g)+3H2(g),P1 =5.0×103 MPa的恒压条件下,各物质平衡时的物质的量分别是CH4 1mol,H2O1mol,CO2mol,H26mol,混合气体的总物质的量为1+1+2+6=10mol,压强平衡常数Kp,气体组分的分压=总压强×(气体组分的物质的量/气体总物质的量),根据公式KP= =
=  =
= =
=![]() ×100=
×100=![]() p12=
p12=![]() ×(5.0×103)2=1.08×108 MPa2
×(5.0×103)2=1.08×108 MPa2
故答案为:>;<;66.7%;1.08×108 MPa2。


科目:高中化学 来源: 题型:
【题目】将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:
![]()
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A.H+、ClO-、Cl2B.H+、ClO-、Cl-C.HCl、ClO-、Cl-D.H+、HClO、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
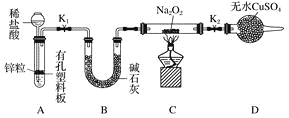
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究苯酚与FeCl3溶液的显色反应,实验如下:
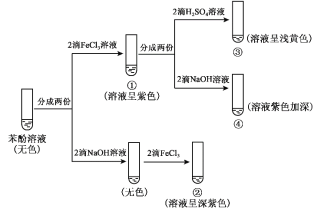
下列说法不正确的是( )
A.苯酚的电离方程式是 ![]()
![]()
![]() +H+
+H+
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①③中的现象说明,滴加稀硫酸后,c(Fe3+)变小
D.对比①②、①④中的现象,说明紫色物质的生成与溶液中c(![]() )相关
)相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH物质的量和所得沉淀的物质的量的关系如图所示。回答下列问题。
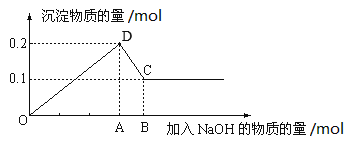
(1)图中CD段反应的化学方程式为___________;C点存在的固体物质为________。
(2)A点的数据为_______;混合液中,MgCl2的浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径X<W
B. 对应气态氢化物的稳定性Y<Z
C. 化合物XZW既含离子键也含共价键
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,____与盐酸反应的速度最慢;____与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为______________________________;
(3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________,________________;
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律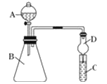
(4)干燥管D的作用为_______________;
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有______________溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是![]()
A.检验稀盐酸和氢氧化钠溶液是否恰好完全反应,可在反应后溶液中滴加无色酚酞溶液,无明显现象,恰好完全反应
B.某液体可能是海水或蒸馏水,将其蒸发结晶,液体消失,无残留物,该液体为蒸馏水
C.某溶液完全蒸发后无固体残留物,该溶液中一定含硫酸根离子
D.某溶液中加入稀盐酸有气泡产生,该溶液中一定含碳酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
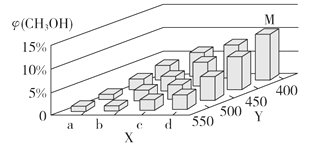
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
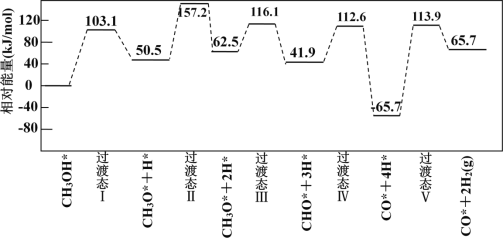
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com