
【题目】[有机化学基础]
龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)
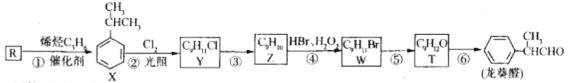
回答下列问题
(1)下列有关R和烯烃C3H6的说法不正确的是_________。(填代号)
A.它们的碳原子均在同一平面 B.它们都能使酸性KMnO4溶液褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应②的类型是____________,反应③的类型是__________。
(3)T所含官能团的名称是___________;反应⑥的化学方程式为________。
(4)X的实验式为_____________。
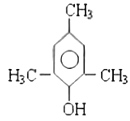
(5)遇氯化铁溶液发生显色反应的T的同分异构体有_______种,其中,在核磁共振氢谱上有4组峰且峰面积比为1:2:3:6的结构简式为________________。
(6)参照上述流程图,以2一甲基-1,3-丁二烯为原料,经三步制备2一甲基-1,4一丁二醛的合成路线:
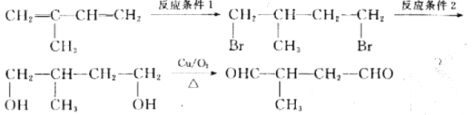
反应条件1所选用的试剂为_________,反应条件2所选用的试剂及条件为_________。
【答案】BD 取代反应 消去反应 羟基  C3H4 22
C3H4 22 
 HBr、H2O2 NaOH水溶液、加热
HBr、H2O2 NaOH水溶液、加热
【解析】
(1)依题意知,R为苯,苯的分子结构中含介于碳碳单键与碳碳双键之间的特殊的键,6个C原子共平面,化学性质稳定,在一定条件下可发生加成反应,不能使酸性高锰酸钾褪色,而烯烃C3H6分子内含碳碳双键,3个C原子共平面,可发生加成反应,据此分析作答;
(2)根据条件及反应产物的分子式推测结构简式及有机反应类型;
(3)采用正推法与逆推法有机结合的思路推出T中含有羟基;
(4)实验式是用元素符号表示化合物分子中各元素的原子个数比的最简关系式,据此分析作答;
(5)遇氯化铁溶液发生显色反应,则说明分子含酚羟基,按照苯环上取代基的个数采用分类讨论思想对同分异构体的种类数进行分析;
(6)根据合成路线可看出合成目标产物的关键是在异戊二烯链上引入溴原子,有题意可知,碳碳双键在H2O2存在下与HBr发生加成反应,溴原子连接在氢原子较多的碳原子上,再结合反应物与产物的转化关系分析作答。
(1)依题意知,R为苯,则
A. 苯的六个C原子共平面,烯烃C3H6中的C原子也共平面,故A项正确,不符合题意;
B. 苯中不含碳碳双键,性质稳定,不能使酸性高锰酸钾褪色,故B项错误,符合题意;
C. 苯在一定条件下可与氢气、氯气等发生加成反应,烯烃C3H6中含碳碳双键也可以发生加成反应,故C项正确,不符合题意;
D. 苯分子内含的化学键介于碳碳单键与碳碳双键之间的特殊的键,不含碳碳双键,故D项错误,符合题意;
故答案选BD;
(2)反应②是由X(![]() )在光照的条件下与Cl2反应转化为Y(
)在光照的条件下与Cl2反应转化为Y(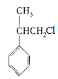 ),可知发生了取代反应,反应③由Y(
),可知发生了取代反应,反应③由Y( )发生消去反应转化为Z(
)发生消去反应转化为Z(![]() ),
),
故答案为:取代反应;消去反应;
(3)W中含溴原子,龙葵醛分子中含醛基,结合分子式及W和龙葵醛的结构简式可推知T为醇,其分子内含羟基,其结构简式为: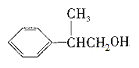 ,则反应⑥的化学方程式为:
,则反应⑥的化学方程式为:
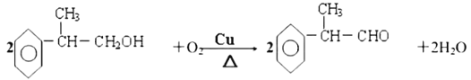 ,
,
故答案为:
羟基;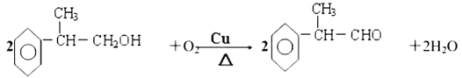 ;
;
(4)X为异丙苯或2-苯基丙烷,分子式为C9H12,则其实验式为C3H4,
故答案为:C3H4;
(5)遇氯化铁溶液发生显色反应,则分子内含酚羟基,则苯环上取代基分三种情况。第一种情况,苯环上连接2个取代基:则为-OH、-C3H7,共6种结构;第二种情况,苯环上连接3个取代基:则为-OH、-CH3、-C2H5,共10种结构;第三种情况,苯环上连接4个取代基:则为1个-OH、3个-CH3,共6种结构,综上所述,符合条件的同分异构体共6+10+6 = 22种。其中,在核磁共振氢谱上有4组峰且峰面积比为1:2:3:6的结构有两种,其结构简式为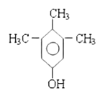 、
、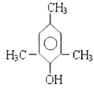 ,
,
故答案为:22; 、
、 ;
;
(6)从流程图可知,第一步反应为加成反应,且溴原子连接在含H较多的C原子上,由上述反应可知,不对称烯烃在H2O2存在下与HBr加成,溴原子连接在氢原子较多的碳原子上,则反应条件1为HBr和H2O2,下一步反应显然是由-Br转化为-OH的过程,则反应条件2为NaOH水溶液、加热,
故答案为:HBr、H2O2;NaOH水溶液、加热。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中华民族的发明创造为人类文明进步做出了巨大贡献。下列我国古代发明中,不涉及化学反应的是( )
A.铜的冶炼B.粮食酿醋
C.打磨磁石制指南针D.火药的发明与使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,关于pH = 2的盐酸,下列说法不正确的是
A. 溶液中c(H+) = 1.0ⅹ10-2 mol/L
B. 加水稀释100倍后,溶液的pH = 4
C. 加入等体积pH = 12的氨水,溶液呈碱性
D. 此溶液中由水电离出的c(OH-) = 1.0ⅹ10-2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,25 ℃时存在着平衡:2NO2(g)![]() N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给150mL某液体加热的操作中,所需的仪器是( )
①试管 ②烧杯 ③酒精灯 ④试管夹 ⑤石棉网 ⑥泥三角 ⑦坩埚 ⑧铁三脚架
A.③⑥⑦⑧B.②③⑤⑧C.①③④⑤D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的A、B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2![]() 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
A. 25%B. 大于25%
C. 小于25%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:CH4(g)+4NO2( g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ·mol-l;CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H=-1160 kJ·mol-1,该条件下CH4(g)还原NO2(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:__________。
(2)已知在448 ℃时,反应H2(g)+I2(g) ![]() 2HI(g)的平衡常数K1为49,则该温度下反应反应
2HI(g)的平衡常数K1为49,则该温度下反应反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g) ![]() HI(g)的平衡常数K3为___________________________。
HI(g)的平衡常数K3为___________________________。
(3)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①)该反应的化学平衡常数表达式为K=________。
②该反应为________(填“吸热”或“放热”)反应。
③能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
⑤在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com