
【题目】(1)已知:CH4(g)+4NO2( g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ·mol-l;CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H=-1160 kJ·mol-1,该条件下CH4(g)还原NO2(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:__________。
(2)已知在448 ℃时,反应H2(g)+I2(g) ![]() 2HI(g)的平衡常数K1为49,则该温度下反应反应
2HI(g)的平衡常数K1为49,则该温度下反应反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g) ![]() HI(g)的平衡常数K3为___________________________。
HI(g)的平衡常数K3为___________________________。
(3)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①)该反应的化学平衡常数表达式为K=________。
②该反应为________(填“吸热”或“放热”)反应。
③能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
⑤在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1 7 ![]() 吸热 BC 830 逆向
吸热 BC 830 逆向
【解析】
(1)①CH4(g)+4NO2( g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ·mol-l,②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H=-1160 kJ·mol-1,应用盖斯定律,将(①+②)/2,CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=![]() kJ·mol-1=-867kJ·mol-1,即CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1;
kJ·mol-1=-867kJ·mol-1,即CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1;
(2)根据化学平衡常数的定义,K1=![]() ,K3=
,K3= ,K1=K32即K3=7;
,K1=K32即K3=7;
(3)①根据化学平衡常数的定义,K=![]() ;
;
②化学平衡常数只受温度的影响,根据表格数据,随着温度的升高,化学平衡常数增大,即正反应方向为吸热反应;
③A、反应前后气体系数之和相等,即反应前后气体物质的量相等,压强不变,不能说明反应达到平衡,故A不符合题意;
B、根据化学平衡状态的定义,c(CO)不变,说明反应达到平衡,故B符合题意;
C、υ正(H2)反应向正反应方向进行,υ逆(H2O)反应向逆反应方向进行,且速率之比等于化学计量数之比,υ正(H2)=υ逆(H2O),能说明反应达到平衡,故C符合题意;
D、没有指明起始浓度,因此c(CO2)=c(CO),不能说明反应达到平衡,故D不符合题意;
答案选BC。
④根据c(CO2)·c(H2)=c(CO)·c(H2O),K=![]() =1,根据表格数据,此温度为830℃;
=1,根据表格数据,此温度为830℃;
⑤Qc=![]() =
=![]() =1>0.9,说明反应向逆反应方向进行;
=1>0.9,说明反应向逆反应方向进行;


科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[有机化学基础]
龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)
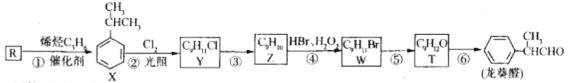
回答下列问题
(1)下列有关R和烯烃C3H6的说法不正确的是_________。(填代号)
A.它们的碳原子均在同一平面 B.它们都能使酸性KMnO4溶液褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应②的类型是____________,反应③的类型是__________。
(3)T所含官能团的名称是___________;反应⑥的化学方程式为________。
(4)X的实验式为_____________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有_______种,其中,在核磁共振氢谱上有4组峰且峰面积比为1:2:3:6的结构简式为________________。
(6)参照上述流程图,以2一甲基-1,3-丁二烯为原料,经三步制备2一甲基-1,4一丁二醛的合成路线:
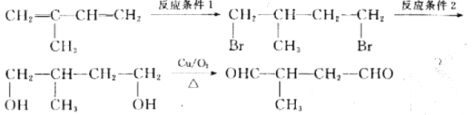
反应条件1所选用的试剂为_________,反应条件2所选用的试剂及条件为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+ Y(g)![]() 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 该温度下此反应的平衡常数K = 1.44
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 反应前2 min的平均速率v(Z) = 2.0×10-3 mol/(L·min)
D. 其他条件不变,再充入0.2 mol X,平衡时Y的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
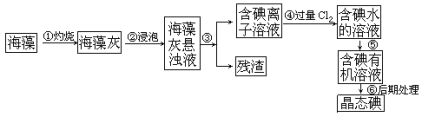
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(填字母)。
A 烧杯 B 坩埚 C 表面皿 D 泥三角 E 酒精灯 F 干燥器
(2)步骤③的实验操作名称是____________,步骤⑤的操作名称是________。
(3)步骤④反应的离子方程式为_________________________________。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,保持一定温度,在一定条件下进行如下反应A(g)+2B(g)![]() 3C(g),已知起始时加入2 mol A(g)和3 mol B(g),达平衡后,生成a mol C(g)。此时,C(g)在反应混合气体中的体积分数为_____________(用含字母a的代数式表示)。
3C(g),已知起始时加入2 mol A(g)和3 mol B(g),达平衡后,生成a mol C(g)。此时,C(g)在反应混合气体中的体积分数为_____________(用含字母a的代数式表示)。
(1)相同实验条件下,若在同一容器中改为开始加入1 mol A和1.5mol B,达平衡时C的物质的量为________mol(用含字母a的代数式表示)。此时C在反应混合物中的体积分数_____________(填“增大”、“减小”或“不变”)。
(2)相同实验条件下,若在同一容器中改为开始时加入2 mol A和2 mol B,达平衡时,要求C在混合物中体积分数与(1)相同,则开始时还需加入_________mol C,平衡时C的物质的量为_______________mol(用含字母a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法不正确的是
A. b>0.01
B. 混合后溶液呈中性
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com