
����Ŀ��Li������Ĺ������������Li��Ϊ�������ϵĵ�ؾ���С���ᡢ�����ܶȴ���������ܣ��õ��㷺Ӧ�á��ش��������⣺
(1)����Liԭ�ӵ����Ų�ͼ��ʾ��״̬�У�������ͺ���ߵķֱ�Ϊ_______��_________��(����)
A�� B��
B��
C�� D��
D��![]()
(2)![]() ��
��![]() ������ͬ�ĵ��ӹ��ͣ�
������ͬ�ĵ��ӹ��ͣ�![]() С��
С��![]() ��ԭ����___________________________��
��ԭ����___________________________��
(3)![]() ���л��ϳ��г��õĻ�ԭ����
���л��ϳ��г��õĻ�ԭ����![]() �е������ӿռ乹����____________________��
�е������ӿռ乹����____________________��

(4)��ͼ��Liԭ�ӵĵ�һ������Ϊ_________![]() ��O=O������Ϊ_________
��O=O������Ϊ_________![]() ��
��
���𰸡�D C �˵�����ߣ��뾶С �������� 520 498
��������
��1�����ݴ��ڻ�̬ʱ�����ͣ����ڼ���̬ʱ�������жϣ�
��2������ԭ�Ӻ˶��������ӵ��������жϣ�
��3�����ݼ۲���ӶԻ������۷������������ʵ�������жϻ�ѧ����
��4����һ����������̬�����Ի�̬ԭ��ʧȥһ������ת��Ϊ��̬��̬����������Ҫ������������ݴ˼��㣻��������ת��Ϊ��ԭ��ʱ�������仯������ܡ�
��1�����ݺ�������Ų����ɿ�֪Li�Ļ�̬��������Ų�ʽΪ1s22s1����D��������ͣ�ѡ��C����2�����Ӵ���2p�ܼ��ϣ�������ߣ�
��2������﮵ĺ˵�����ϴ�ԭ�Ӻ˶��������ӵ��������ϴ����Li���뾶С��H����
��3��LiAlH4�е���������AlH4��������ԭ����ԭ�Ӻ��еļ۲���Ӷ�����4���Ҳ����ڹ¶Ե��ӣ����Կռ乹�����������壻
��4������ʾ��ͼ��֪Liԭ�ӵĵ�һ��������![]() ��520 kJ/mol��0.5mol����ת��Ϊ��ԭ��ʱ������249 kJ������O��O������249 kJ/mol��2��498 kJ/mol��
��520 kJ/mol��0.5mol����ת��Ϊ��ԭ��ʱ������249 kJ������O��O������249 kJ/mol��2��498 kJ/mol��


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���Ba2+��Cu2+,Ag+������NaOH��Һ�������Na2SO4��Һ��������������һ�������롣������ͼ����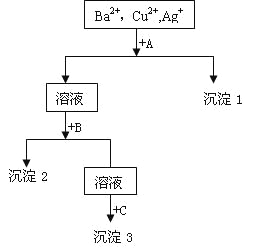
��1�������Ļ�ѧʽ������1___________������2__________������3____________��
��2��д�����Һ+A�����ӷ���ʽ________________________________________��
��Һ+B�����ӷ���ʽ_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϊij�л���������Լ��ķ�Ӧ�����������л��������
�Լ� | �� | ��ˮ | NaHCO3��Һ |
���� | �ų����� | ��ɫ | �ų����� |
A. CH2�TCH��CH2��OHB. ![]()
C. CH2�TCH��COOHD. CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����³�ѹ�£���������CH4��A��������֮��Ϊ15:8,��A��Ħ������Ϊ________��
��2����֪��״���£�H2��O2�Ļ���������Ϊ11.2L,��Ϻ�������Ϊ13�ˣ����������ƽ��Ħ������Ϊ_________,���л������������Ϊ__________��
��3����֪ij��ֲ��Ӫ��Һ�䷽���£�0.6mol KCl,0.4molK2SO4 ��0.2mol ZnSO4��1Lˮ������KCl��K2SO4��ZnCl2��ˮ�����ƣ�����KCl______mol��K2SO4___________mol��ZnCl2_____________mol��
��4��ij��������A��һ�����������ȷֽ���ﶼ�����壬�йػ�ѧ����ʽΪ��2A��B����2C����2D���������ɵĻ�����������������ܶ�Ϊd����A����Է�������Ϊ_______(��d��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CH4��Cl2����ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС����ʵ������ģ���������̣�����Ƶ�ģ��װ����ͼ��ʾ������Ҫ����գ�
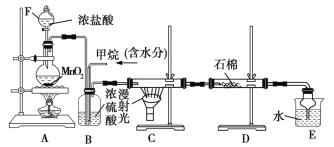
��1��ʵ������ȡCl2�Ļ�ѧ��Ӧ����ʽΪ__________��
��2����V(Cl2)/V(CH4)=x�������������������HCl����x��ȡֵ��ΧΪ____��
��3��Bװ�������ֹ��ܣ��ٿ����������٣��ڽ������Ͼ��ȣ���___________��
��4��Dװ���е�ʯ����������KI������Һ��KI��ĩ����������___________________��
��5��Eװ�õ�������____(����ĸ��˫ѡ)��
A���ռ����� B������Cl2
C����ֹ���� D������HCl
��6��Eװ���Ƶõ������л������л�������߷������ѷ���Ϊ________��
��7����װ�û�����ȱ�ݣ�ԭ����û�н���β��������β������Ҫ�ɷ���____(����ĸ��˫ѡ)��
A��CH4�� B��CH3Cl�� C��CH2Cl2��D��CHCl3��E.CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����������ƽ���ƶ�ԭ�����ǣ� ��
A. ����ơ������ĭ�ݳ�
B. ��FeCl3��Һ�м�KSCN����![]() Fe��SCN)3(Ѫ��ɫ)+3KCl��Ӧ��ƽ�������ϵ�м���KCl���壬ʹ��ϵ��ɫ��dz
Fe��SCN)3(Ѫ��ɫ)+3KCl��Ӧ��ƽ�������ϵ�м���KCl���壬ʹ��ϵ��ɫ��dz
C. װ��![]() ����ƿ������ˮ����ɫ����
����ƿ������ˮ����ɫ����
D. ʵ�������ű���ʳ��ˮ�ķ����ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ���Ư����ɱ���������������������Ʊ��治���������տ�����CO�������ʡ�
��1��ij����С����̽��ij����������Ʒ�Ƿ��Ѿ����ʣ�ȡ������Ʒ���ܽ⣬����__________��Һ��������а�ɫ������֤��Na2O2�Ѿ����ʡ�
��2���ÿ���С��Ϊ�˴��Բⶨ�������ƵĴ��ȣ����dz�ȡa g��Ʒ�����������ͼװ�����ⶨ�������Ƶ�����������

��A�з�����Ӧ���ӷ���ʽΪ_____________________��
�����������Ӻ��Ժ�����еĵ�һ��������_____________________��
��Bװ�ó����������Ƿ���Ҫ����_________________������ǡ���
��д��װ��C�з��������з�Ӧ�Ļ�ѧ����ʽ_____________��______________��
��D��NaOH��Һ������_______________________��
��ʵ�����ʱ����ȡʵ����������������ʱ������������_______________��
a.ֱ�Ӷ�ȡ���������������ȴ������
b.�����ƶ���Ͳ��ʹ��E��F��Һ��߶���ͬ
c.�����밼Һ�����͵���ƽ��ȡ��Ͳ��ˮ�����
��������Ͳ��ˮ�����������ɱ�״�������������ΪV mL������Ʒ�й������Ƶ���������Ϊ__________________��
��ʵ����ɺ�E��F֮�䵼���ڲ���ˮ�������ʹ�������__________�����ƫ����ƫС����Ӱ�족��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ���������ֵΪNA��������˵����ȷ����(����)
A. ���³�ѹ�£�11.2 L�����к��е���ԭ����Ϊ2NA
B. ��״���£�0.3 mol���������к��е���ԭ����Ϊ0.3��6.02��1023
C. ��״���£�2.7 g Al�����������ᷴӦ������H2�������22.4L
D. �����£�1 L 0.1 mol��L��1MgCl2��Һ�к�Cl����Ϊ0.2moL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ�����ϲ�ѯ����ʱ��֪�������CO2��Na2O2���ܷ�Ӧ��ֻ����ˮ���������¶��߲��ܷ�����Ӧ�������������ͼ��ʾʵ��װ�ã�������֤�������ۡ�
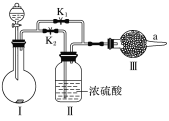
(1)װ�â��е��Լ�����������________(����ĸ)��
a��ϡ���� b��ϡ����
c��С�մ� d��ʯ��ʯ
(2)ʵ��ʱ����ͬѧ��Ϊ�ر�K1����K2��ͨ���۲�________�жϴ�ʱ�����Ƿ����˻�ѧ��Ӧ��
(3)��ͬѧ��Ϊ���Էֱ����ȹر�K1����K2���ٹر�K2����K1���ķ�ʽ���в���������a���ռ��������壬Ȼ���ô����ǵ�ľ�������ռ��������壬�����������������ľ����û�и�ȼ��
�ٱ�ͬѧ�����۲�����������ڢ��װһ��ʢ�м�ʯ�ҵĸ���ܣ�Ŀ����________________
�ڶ�ͬѧ��Ϊ��ʹ���ɱ�ͬѧ�Ľ��������չ۲쵽ľ����ȼ��Ҳ����֤��CO2�����˷�Ӧ��ԭ����________________________
(4)Ϊ��һ���ﵽʵ��Ŀ�ģ�Ӧ�����ʵ������ǣ�ȡ���շ�Ӧ��������ù��壬____________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com