
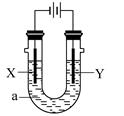
| A.若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液 |
| B.若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色 |
| C.若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol |
| D.若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1 |
 2Cu+ 2H2SO4+O2↑ 从上述方程式可以看出,电解硫酸铜过程中,只析出铜和释放出氧气。因此电解后加入CuO就可以使溶液复原。本题加入Cu(OH)2后溶液复原,说明电解过程中还有水被电解(因为硫酸铜被电解完全)。0.1molCu(OH)2可以可以看作是0.1mol的CuO和0.1mol H2O,因此电解过程中有0.1mol的硫酸铜和0.1mol的水被电解,转移电子的物质的量是0.4mol,错误;D、电解硫酸铜和硝酸钾混合溶液,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电析出铜,当铜完全析出时,氢离子放电析出氢气,根据转移电子守恒计算析出铜的物质的量,再结合物质的量浓度公式计算硫酸铜溶液浓度。
2Cu+ 2H2SO4+O2↑ 从上述方程式可以看出,电解硫酸铜过程中,只析出铜和释放出氧气。因此电解后加入CuO就可以使溶液复原。本题加入Cu(OH)2后溶液复原,说明电解过程中还有水被电解(因为硫酸铜被电解完全)。0.1molCu(OH)2可以可以看作是0.1mol的CuO和0.1mol H2O,因此电解过程中有0.1mol的硫酸铜和0.1mol的水被电解,转移电子的物质的量是0.4mol,错误;D、电解硫酸铜和硝酸钾混合溶液,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电析出铜,当铜完全析出时,氢离子放电析出氢气,根据转移电子守恒计算析出铜的物质的量,再结合物质的量浓度公式计算硫酸铜溶液浓度。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol | B.0.2mol | C.0.4mol | D.0.8mol 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | Cu(OH)2 | CuOH | CuCl | Cu2O |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
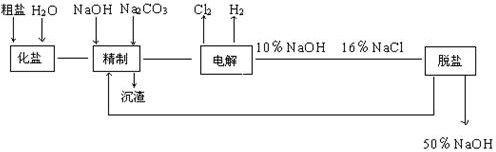
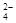 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO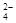 ,该钡试剂可以是(选填A.B.c,多选扣分)
,该钡试剂可以是(选填A.B.c,多选扣分) 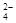 ,加入试剂的合理顺序为(选填a,b,c多选扣分)
,加入试剂的合理顺序为(选填a,b,c多选扣分)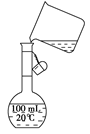
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳极发生还原反应,其电极反应式:Ni2++2e-= Ni |
| B.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| C.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
| D.电解后,电解槽底部的阳极泥中只有Pt |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.Cu(OH)2 | B.Cu2O | C.CuCO3 | D.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电镀时铁皮连接电源正极 | B.电镀时锌块发生氧化反应 |
| C.电镀液中Zn2+浓度明显下降 | D.电镀液中电子由铁流向锌 |
查看答案和解析>>
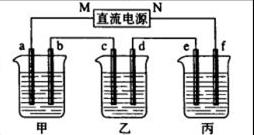
科目:高中化学 来源:不详 题型:单选题

| A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1 mol NaOH |
| B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 |
| C.M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
| D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com