
【题目】常温下,0.1mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法正确的是( )

A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2(H2C2O4)=4.17
C.0.1mol·L-1NaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
【答案】BC
【解析】
H2C2O4在水溶液中的电离平衡:H2C2O4![]() HC2O4-+H+,HC2O4-
HC2O4-+H+,HC2O4-![]() C2O42-+H+,pH减小(H+浓度增大),平衡逆向移动,pH增大(H+浓度减小),平衡正向移动,所以,pH最小时,溶液中的含碳粒子主要是H2C2O4,pH最大时,溶液中的含碳粒子主要是C2O42-,曲线①代表H2C2O4的含量,曲线③代表C2O42-的含量,曲线②代表HC2O4-的含量。
C2O42-+H+,pH减小(H+浓度增大),平衡逆向移动,pH增大(H+浓度减小),平衡正向移动,所以,pH最小时,溶液中的含碳粒子主要是H2C2O4,pH最大时,溶液中的含碳粒子主要是C2O42-,曲线①代表H2C2O4的含量,曲线③代表C2O42-的含量,曲线②代表HC2O4-的含量。
A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),A项错误;
B.Ka2(H2C2O4)=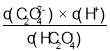 ,用曲线②与曲线③的交点数据计算,c(HC2O4-)=c(C2O42-),该点的pH=b=4.17,c(H+)=10-4.17,代入公式,得Ka2(H2C2O4)= c(H+)=10-4.17,pKa2(H2C2O4)=-lg(10-4.17)=4.17,B项正确;
,用曲线②与曲线③的交点数据计算,c(HC2O4-)=c(C2O42-),该点的pH=b=4.17,c(H+)=10-4.17,代入公式,得Ka2(H2C2O4)= c(H+)=10-4.17,pKa2(H2C2O4)=-lg(10-4.17)=4.17,B项正确;
C.0.1mol·L-1NaHC2O4溶液中,电荷守恒式:c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HC2O4-)①,物料守恒式:c(Na+)= c(H2C2O4) +c(HC2O4-)+c(C2O42-)②,①②联立,消掉c(Na+),得c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4),C项正确;
D.CaC2O4饱和溶液中存在溶解平衡:CaC2O4(s)![]() Ca2+(aq)+C2O42-(aq),加入少量CaCl2固体,c(Ca2+)增大,平衡逆向移动,c(C2O42-)减小,根据勒夏特列原理,达到新的平衡时,c(Ca2+)仍比原平衡大,D项错误;
Ca2+(aq)+C2O42-(aq),加入少量CaCl2固体,c(Ca2+)增大,平衡逆向移动,c(C2O42-)减小,根据勒夏特列原理,达到新的平衡时,c(Ca2+)仍比原平衡大,D项错误;
答案选BC。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①![]()
②![]()
回答下列问题:
(1)A的化学名称是______________________。
(2)由C生成D和E生成F的反应类型分别是_____________________、____________________。
(3)E的结构简式为______________________________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______________________________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出2种符合要求的X的结构简式:_______________。
(6)写出用环戊烷和2-丁炔为原料制备化合物的合成路线(其他试剂任选) _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试用相关知识回答下列问题:
(1)有机物大多难溶于水,而乙醇和乙酸可与水互溶,原因是_______。
(2)乙醚(![]() )的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是_________________。
)的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是_________________。
(3)从氨合成塔里分离出NH3,通常采用的方法是_____________,原因是_____________。
(4)水在常温下的组成的化学式可用(H2O)n表示,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
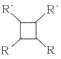
【题目】已知C—C键可以旋转,下列对结构简式如下图的烃的说法正确的是( )

A.该烃属于苯的同系物
B.分子中至少有9个碳原子处于同一平面上
C.分子中至少有10个碳原子处于同一平面上
D.分子中至少有11个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li—SOCl2电池是迄今具有最高能量比的电池。该电池的电极材料分别为锂和碳,电解液(熔点-110℃、沸点78.8℃)是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。下列说法正确的是( )
A.该电池不能在寒冷地区正常工作
B.SOCl2分子的空间构型是平面三角形
C.该电池工作时,正极反应为:2SOCl2+4e-=4Cl-+S+SO2
D.该电池组装时,必须在无水无氧条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
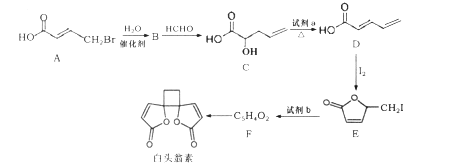
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成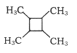 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质为3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:

已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是___。操作Ⅰ的名称是___。
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____。
(3)将pH控制在3.6的目的是___。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=___。
Cu(OH)2+2H+的平衡常数K=___。
(4)加入双氧水时反应的离子方程式为___。
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1kg,写出该反应完整的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C2H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法不正确的是( )
A.二茂铁属于分子晶体
B.在二茂铁中,C5H5-与Fe2+之间形成的化学键类型是离子键
C.已知环戊二烯的结构式为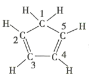 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H5-中一定含有![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物, 研究发现,该药在细胞水平上能有效抑制新型冠状病毒的感染。其合成路线如下:
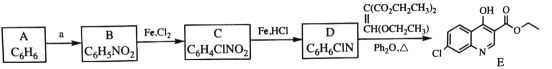

已知:

回答下列问题:
(1)A是一种芳香经, B 中官能团的名称为__________________。
(2)反应 A→B 中须加入的试剂a 为___________________。
(3)B 反应生成 C 的反应化学反应方程式是______________________。
(4)C→D 反应类型是_________, D的结构简式为_______________。
(5)F→G反应类型为________________。
(6)I是E的同分异构体,与E 具有相同的环状结构, 写出任意一种符合下列条件的I的结构简式是__________________________。
①I是三取代的环状有机物, 氯原子和羟基的取代位置与E相同;
②核磁共振氢谱显示I 除了环状结构上的氢外,还有4组峰, 峰面积比3:1:1:1;
③I加入NaHCO3溶液产生气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com