
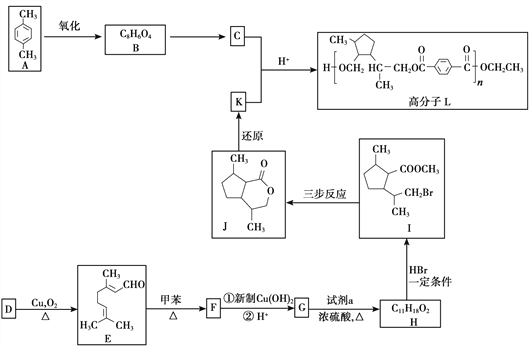
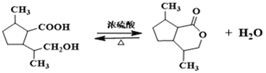
【题目】香叶醇(D)是一种特殊的香料,也是一种重要的有机合成的原料。由香叶醇合成功能高分子L的合成路线如下:
已知:
Ⅰ.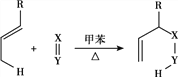 (R代表烃基,X=Y代表C=C、C=O等不饱和键,可与其他基团相连)
(R代表烃基,X=Y代表C=C、C=O等不饱和键,可与其他基团相连)
Ⅱ.![]()
(1)A的名称是__________。
(2)B的结构简式是__________。
(3)D中官能团的名称是__________。
(4)试剂a是__________。
(5)由H得到I的反应类型是__________。
(6)由E生成F的化学方程式是__________。
(7)由I合成J需经历三步反应,其中第一步、第三步的化学方程式分别是
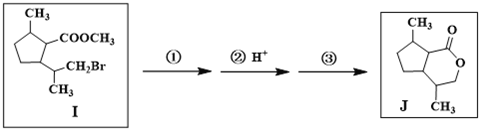
第一步:_______________________________________________
第三步:_______________________________________________
【答案】 对二甲苯(1,4-二甲苯) 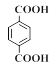 碳碳双键、羟基 甲醇(CH3OH) 加成反应
碳碳双键、羟基 甲醇(CH3OH) 加成反应 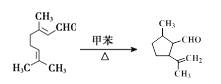
【解析】根据流程图,对二甲苯(A)氧化生成B,B为对苯二甲酸;根据E的结构和生成E的条件可知,D中含有醇羟基,D为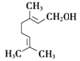 ,根据信息I,E中碳碳双键发生加成反应生成F,F为
,根据信息I,E中碳碳双键发生加成反应生成F,F为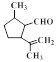 ,F与新制氢氧化铜悬浊液反应后酸化生成G,G为
,F与新制氢氧化铜悬浊液反应后酸化生成G,G为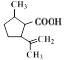 ,根据H生成I的反应,结合G的结构可知,H为
,根据H生成I的反应,结合G的结构可知,H为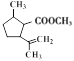 ;J(
;J(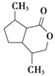 )发生水解反应生成K,K为
)发生水解反应生成K,K为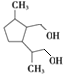 ,根据信息II,结合L的结构可知,C为对苯二甲酸二甲酯(
,根据信息II,结合L的结构可知,C为对苯二甲酸二甲酯(![]() )。
)。
(1)A的名称为对二甲苯,故答案为:对二甲苯;
(2)根据上述分析,B的结构简式为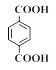 ,故答案为:
,故答案为: ;
;
(3)D( )中官能团有碳碳双键、羟基,故答案为:碳碳双键、羟基;
)中官能团有碳碳双键、羟基,故答案为:碳碳双键、羟基;
(4)根据上述分析,G( )与甲醇发生酯化反应生成H(
)与甲醇发生酯化反应生成H( );试剂a是甲醇(CH3OH),故答案为:甲醇(CH3OH);
);试剂a是甲醇(CH3OH),故答案为:甲醇(CH3OH);
(5)H与溴化氢发生加成反应生成I,故答案为:加成反应;
(6)E中碳碳双键发生加成反应生成F,反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(7)由I合成J需经历三步反应,可以首先将溴原子水解生成羟基,酯基水解生成盐,酸化后发生分子内的酯化反应即可,其中第一步、第三步的化学方程式分别是 、
、 ,故答案为:
,故答案为: ;
; 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3 . 其中HNO3为反应物,则该反应中的还原剂为( )
A.NO
B.BFeSO4
C.Fe(NO3)3
D.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.H2CO32H++CO32﹣
B.NaHSO4=Na ++HSO4﹣
C.NaHCO3=Na++H++CO32﹣
D.NH4Cl=NH4++Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的叙述,正确的是( )
A.NaCl溶液在电流作用下电离出Na+和Cl-
B.凡是溶于水后能电离出H+的化合物就叫酸
C.HCl溶液能导电,而液态的HCl难以导电
D.难溶物一定不属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下面列出了几组物质,请将物质的合适序号填写在空格上。
①金刚石和石墨 ②D和T ③12C和13C ④O2和O3
⑤CH4和CH3CH2CH3 ⑥CH2=CHCH3和CH2=CH2
⑦CH3CH(CH3)CH2CH3和CH3(CH2)3CH3 ⑧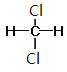 和
和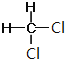
同系物____________;同分异构体____________。
Ⅱ.篮烷分子的键线式如图所示,试回答:
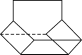
篮烷的一氯代物的种数为________种(不考虑立体异构)。
Ⅲ.在一定温度下,体积为2 L的恒容密闭容器中,NO2和N2O4之间发生反应2NO2(g) ![]() N2O4(g),如图所示。
N2O4(g),如图所示。
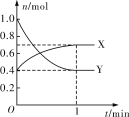
(1)曲线____________ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)该反应达到限度时,Y的转化率是__________,反应开始时与反应达到平衡状态时的压强之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、Na、S是常见的六种元素。请回答下列问题。
(1)S在元素周期表中的位置为______________。
(2)上述元素中非金属性最强的是______________(填元素符号)。
(3)下列事实能说明O的非金属性比S的非金属性强的是________(填字母代号)。
a.O2与H2S溶液反应,溶液变浑浊
b.加热条件下H2S比H2O更容易分解
c.在氧化还原反应中,1 mol O2比1 mol S得电子多
d.H2O的沸点比H2S高
(4)一定条件下,Na还原CCl4可得到金刚石与一种可溶性盐,该反应的化学方程式为_________________。
(5)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
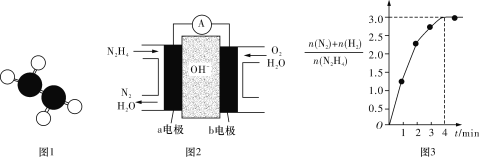
①已知肼的球棍模型如图1所示,试写出肼的电子式:______________。
②目前正在研发的一种肼燃料电池的结构如图2所示,________(填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应N2H4(l) ![]() N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________。
N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,体积均为50mL物质的量浓度均为0.10mol/L的HX、HY、HZ三种弱酸,分别用0.10mol/L的NaOH溶液滴定,滴定曲线如图所示。下列有关说法错误的是
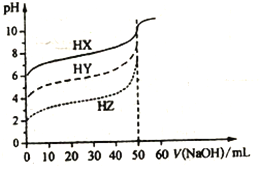
A. 浓度均为0.10mol/L时,酸的电离度:HX<HY<HZ
B. pH均为3.0的三种酸加水稀释至pH均为6.5,加入水的量:HX>HY>HZ
C. 图中当均滴入50mLNaOH溶液时,所得溶液中水的电离程度:HX>HY>HZ
D. 用NaOH溶液中和pH与体积均相等的三种酸时,消耗n(NaOH):HX<HY<HZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)2SO2(g)+O2(g)2SO3(g)反应过程的能虽变化如图所示.己知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJ/mol. 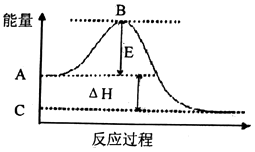
请回答下列问题:
①E的大小对该反应的反应热(填“有”或“无”)影构.
②图中△H=kJ/mol.
(2)由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得) ①写出该反应的热化学方程式: .
②若lmol水蒸气转化为液态水放热45kJ,则反应H2(g)+ ![]() O2(g)=H2O(l)的△H=kJ/mol.
O2(g)=H2O(l)的△H=kJ/mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com