
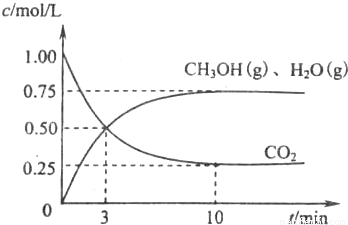
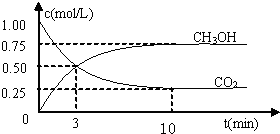
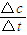 计算出v(H2);
计算出v(H2);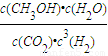 ;
; CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g), CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g); CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)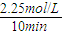 =0.225mol/(L.min),
=0.225mol/(L.min),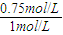 ×100%=75%,
×100%=75%,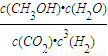 =
=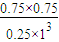 =2.25,
=2.25,

科目:高中化学 来源: 题型:
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 16 |
| 3 |
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
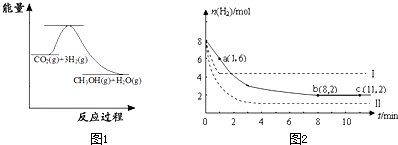
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
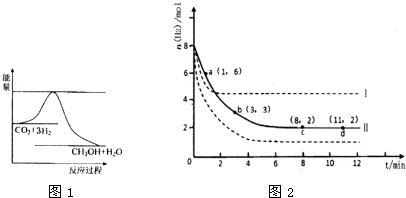
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
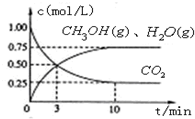
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com