
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
| B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
| C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| D | 0.03 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
分析 通入混合液中通入二氧化碳气体后,NaOH优先反应生成碳酸钠,0.02mol氢氧化钠消耗0.01mol二氧化碳,生成0.01mol碳酸钠;然后偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸钠,0.01mol偏铝酸钠消耗0.005mol二氧化碳,生成0.005mol碳酸钠,此时碳酸钠的总物质的量为0.015mol;若之后再通入二氧化碳,二氧化碳会开始碳酸钠反应生成碳酸氢钠,0.015mol碳酸钠总共消耗0.015mol的二氧化碳,反应后生成0.03mol的碳酸氢钠,
A.没有通入二氧化碳时,溶液中溶质为偏铝酸钠,根据偏铝酸钠溶液中的电荷守恒c(Na+)+c(H+)=c(AlO2-)+c(OH-)分析;
B.当通入0.01mol二氧化碳时,所得溶液中溶质为0.01mol碳酸钠和0.01mol偏铝酸钠,因为碳酸酸性强于氢氧化铝,所以偏铝酸根离子水解程度比碳酸根离子强,则偏铝酸根离子浓度小于碳酸根离子浓度;
C.当通入0.015mol二氧化碳时,0.02molNaOH优先与0.01mol二氧化碳反应生成0.01mol碳酸钠,剩余的0.005mol二氧化碳恰好与0.01molNaAlO2反应生成氢氧化铝沉淀和0.005mol碳酸钠,所以反应后溶液中溶质为0.015molNa2CO3,则c(CO32-)>c(HCO3-);
D.通入0.03mol二氧化碳时,相当于在C的基础上再通入0.015mol二氧化碳,则反应后溶质为碳酸氢钠,碳酸氢根离子的水解程度大于其电离程度,溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒判断.
解答 解:通入混合液中通入二氧化碳气体后,NaOH优先反应生成碳酸钠,0.02mol氢氧化钠消耗0.01mol二氧化碳,生成0.01mol碳酸钠;然后偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸钠,0.01mol偏铝酸钠消耗0.005mol二氧化碳,生成0.005mol碳酸钠,此时碳酸钠的总物质的量为0.015mol;若之后再通入二氧化碳,二氧化碳会开始碳酸钠反应生成碳酸氢钠,0.015mol碳酸钠总共消耗0.015mol的二氧化碳,反应后生成0.03mol的碳酸氢钠,
A.未通入CO2时,NaAlO2溶液中存在电荷守恒:c(Na+)+c(H+)=c(AlO2-)+c(OH-),则c(Na+)<c(AlO2-)+c(OH-),故A错误;
B、当n(CO2)=0.01mol时,所得溶液中溶质为0.01mol碳酸钠和0.01mol偏铝酸钠,由于碳酸酸性强于氢氧化铝,所以偏铝酸根离子水解程度比碳酸根离子强,则c(CO32-)>c(AlO2-),正确的离子浓度大小为:c(Na+)>c(CO32-)>c(AlO2-)>c(OH-),故B错误;
C.当n(CO2)=0.015mol时,0.02molNaOH优先与0.01mol二氧化碳反应生成0.01mol碳酸钠,剩余的0.005mol二氧化碳恰好与0.01molNaAlO2反应生成氢氧化铝沉淀和0.005mol碳酸钠,所以反应后溶液中溶质为0.015molNa2CO3,则c(CO32-)>c(HCO3-),正确的离子浓度的关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故C错误;
D.当n(CO2)=0.03mol时,根据C可知,0.015molNa2CO3恰好与0.015mol二氧化碳反应生成0.03molNaHCO3,由于HCO3-的水解程度大于电离程度,溶液显碱性,则离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目浓度较大,正确判断反应后溶质组成为解答关键,注意明确发生反应的先后顺序,能够根据盐的水解原理、电荷守恒判断溶液中各离子浓度大小,试题侧重考查学生的分析、理解能力及灵活应用能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 36.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,+7 | B. | 2,+6 | C. | 4,+7 | D. | 4,+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.012 kg 12C中含有约 6.02×1023 个碳原子 | |
| B. | 1 mol H2O中含有2 mol氢和1 mol氧 | |
| C. | 氢氧化钠的摩尔质量等于它的相对分子质量 | |
| D. | 2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
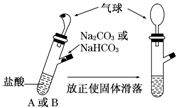 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )| A. | A装置的气球膨胀速率大 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na +、Cl - 的物质的量一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com